Introducción
La proteína Hsp90 (del inglés ‘heat shock protein’ o proteína de choque térmico) es una chaperona de 90 kDa que favorece el plegamiento de otras proteínas, permitiéndolas adquirir su conformación tridimensional
nativa y, con ello, desempeñar su función biológica. Como se trata de una chaperona, comparte una característica fundamental con el resto de proteínas de esta familia, ya que es capaz de estabilizar proteínas en situaciones
de estrés térmico y permitir que se degraden aquellas que estén mal plegadas, evitando la formación de agregados amiloides.
Al igual que el resto de chaperonas, la expresión de Hsp90 se ve incrementada en situaciones de estrés térmico. En condiciones fisiológicas son una de las proteínas más abundantes en el citosol, suponiendo el 1-2% del total
del proteoma, mientras que, bajo condiciones desnaturalizantes, se incrementa considerablemente su expresión, hasta el 4-6%.
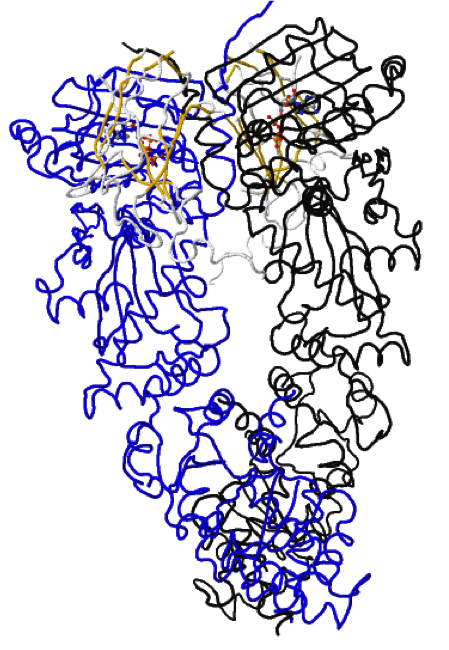
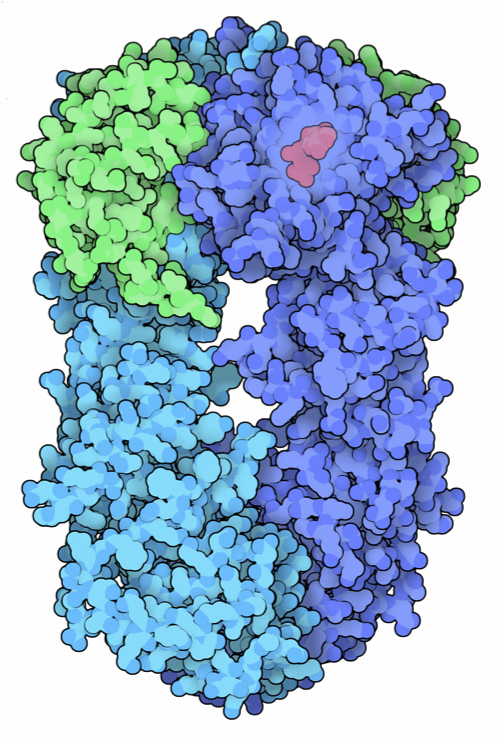 Figura 1: Estructura dimérica de Hsp90 de levadura (monómeros en azul) interaccionando con la cochaperona p53/Sba1 (verde) y ATP (rojo).
Figura 1: Estructura dimérica de Hsp90 de levadura (monómeros en azul) interaccionando con la cochaperona p53/Sba1 (verde) y ATP (rojo).
Hsp90 es una chaperona especializada que actúa sobre proteínas muy variadas implicadas en la transducción de señales, incluidas quinasas y factores de transcripción. La Hsp90 actúa a continuación de la chaperona
Hsp70 en el proceso de plegamiento de estas proteínas y lo hace en colaboración con otros reguladores y co-chaperonas que tienen diversas actividades auxiliares a la función de Hsp90 o que participan en la transferencia o unión
del sustrato al sitio activo.
Las funciones que Hsp90 puede realizar sobre las proteínas diana son principalmente tres: permitir el plegamiento y la activación; favorecer el ensamblaje, y facilitar la unión específica entre la proteína diana y un ligando específico de ésta. Muchas
de las proteínas diana de Hsp90 están relacionadas con la proteostasis (que consiste en mantener la homeostasis del proteoma) lo que le confiere efectos pleiotrópicos que la involucran en una gran variedad
de procesos celulares relacionados con el crecimiento celular como la regulación del desarrollo y el ciclo celular, la activación de la ruta de señalización desencadenada por la percepción de esteroides, la reparación del DNA o la respuesta inmune en enfermedades neurodegenerativas e infecciones por virus y protozoos.
Entre las proteínas sobre las que actúa Hsp90 destacan varios factores de transcripción y quinasas, dentro de las cuales podemos encontrar los receptores de esteroides, la proteína de fusión BCR-ABL, quinasas dependientes
de ciclinas como la Cdk4, o la proteína HER2 que se relaciona con el desarrollo de determinados tipos de cáncer de mama. De hecho, su papel en la actividad de una gran variedad de oncogenes ha hecho que se considere
objeto de estudio para el desarrollo de terapias contra el cáncer. Además, se ha descubierto que las células cancerígenas dependen en gran medida de las Hsp90, incluso más que las células normales, por lo que los fármacos que se usen
teniendo como diana hsp90 (ya sea para inhibir su expresión o favorecer su ubiquitinación) serán altamente específicos para las células cancerígenas.
Estructura
La Hsp90 es un dímero cuyos protómeros se encuentran unidos entre sí por sus extremos C-terminales. En el enlace siguiente, un monómero está representado de color negro y el otro de color
azul; también se muestra la cochaperona
p53/Sba1 en blanco y amarillo, y el
ATP en el modelo bola-varilla.
Conformación dimérica de Hsp90 de levadura y la cochaperona p23/Sba1.
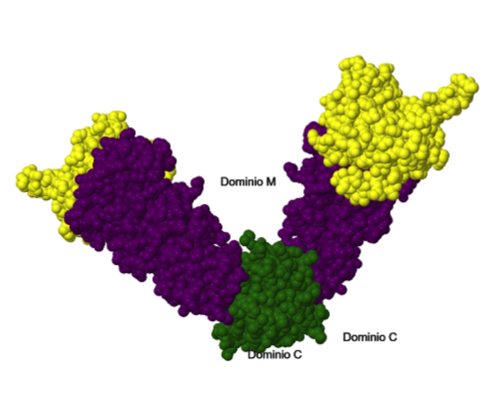
Como se observa en el modelo mostrado más abajo, cada uno de los dos protómeros del dímero que constituyen Hsp90 posee tres dominios: un dominio N-terminal o dominio N, un dominio intermedio M y un dominio C-terminal o domino C.
- Dominio N (en color
amarillo en el modelo): se trata de un sándwich de dos capas formado por una lámina beta plegada en un extremo y un grupo de hélices alfa en el otro, delimitando el sitio de unión al
ATP (en
rojo en el modelo) y a ciertos inhibidores. El dominio N está conectado con el dominio intermedio a través de una hebra beta. El domino N terminal posee un segmento que forma una tapa, de modo que durante el cambio
conformacional la estructura pasa de un estado abierto a un estado cerrado, lo que tendrá importancia en el mecanismo catalítico.
- Dominio intermedio M (en color
morado en el modelo): está constituido a su vez por dos dominios, un dominio alfa-beta-alfa largo (residuos 273-409), conectado a través de un bucle helicoidal a otro dominio alfa-beta-alfa corto (residuos 435-525). Existe
un
lazo anfipático (residuos 329-339, marcado en
azul en el modelo), implicado en la interacción con la proteína diana, que se extiende desde la cara interna del dominio de longitud larga hacia su equivalente en el otro monómero. Un extenso lazo conecta el dominio
intermedio con el inicio de una alfa hélice al inicio del dominio C.
- Dominio C (en color
verde en el modelo): constituido por una lámina beta, a su vez formada por tres hebras beta, empaquetada debajo de la hélice alfa que conecta con el dominio intermedio, y tapando una de las caras de un haz de tres hélices;
mientras que la otra cara forma la interfaz constitutiva de dimerización. El
segmento de hélice constituido por los residuos 587-610 (marcado
naranja), se proyecta desde el núcleo del dominio C hasta el extremo N-terminal del dímero y está involucrado en las interacciones diméricas con su equivalente en el otro protómero.
En el cristal se puede observar también en color blanco p53/Sba1, cochaperona de Hsp90.
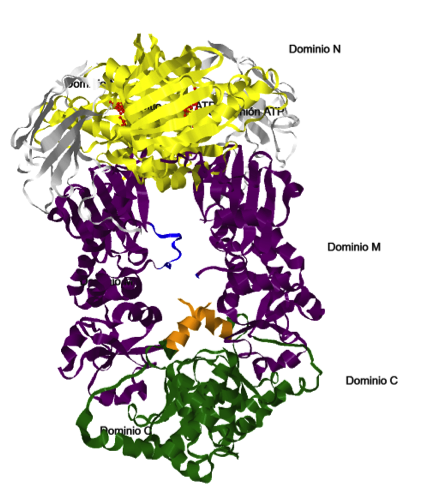
Dominios de los monómeros de Hsp90.
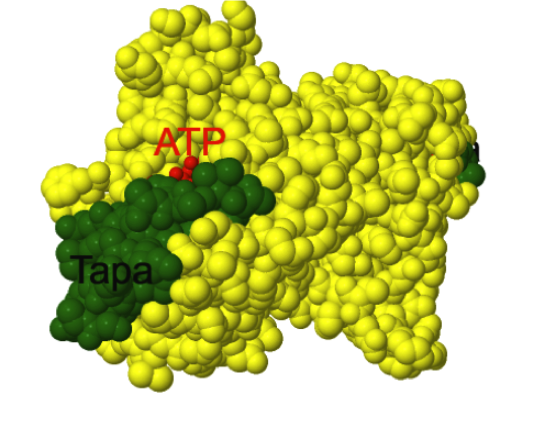
Sitio de unión a ATP
El sitio de unión a ATP juega un papel fundamental en el funcionamiento de la chaperona. Se encuentra en el dominio N-terminal de cada protómero y se presenta como una hendidura con alta afinidad por el ATP. El sitio de unión
posee una tapa, en
verde en la estructura mostrada más abajo, que se encuentra abierta cuando la proteína está unida a ADP y cerrada cuando se une ATP. Después de la unión de ATP se producen una serie de cambios conformacionales
que modifican las propiedades superficiales del dominio N-termina que influyen en la afinidad de la Hsp90 por las proteínas sustrato. En la siguiente estructura se puede ver el dominio N-terminal de Hsp90 en forma de dímero, con la
tapa en verde y el
ATP en rojo.
Sitio de unión a ATP.
Tanto el
ATP como el ADP se encuentran ligados a la proteína a través de numerosas uniones, fundamentalmente en forma de puentes de hidrógeno. El fosfato gamma del ATP forma puentes de hidrógeno con el esqueleto peptídico de
los aminoácidos Gln 119, Gly 121, Val 122 y Gly 123 (en
azul en el modelo mostrado más abajo). El fosfato beta forma puentes de hidrógeno con los aminoácidos Phe 124 y Gly 100 (en
verde en el modelo). También se produce un puente de hidrógeno entre el N6 de la adenina y el residuo
Asp 79 (en
morado). A excepción de este último, todos los puentes de hidrógeno son indirectos, es decir, están mediados por moléculas de agua. Se produce también una interacción polar entre el
ATP y el residuo Arg 380 , perteneciente al dominio intermedio, que se proyecta hasta el sitio de unión. El residuo Glu 33 (en
amarillo) no se une a la molécula de ATP pero es fundamental para la actividad catalítica. Las mutaciones en los residuos Arg 380 y
Glu 33 impiden la actividad catalítica, mientras que las mutaciones en
Asp 79 impiden la unión de ATP.
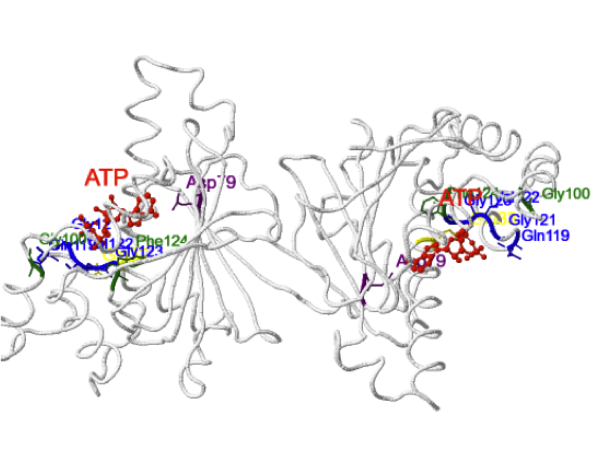
Detalle del sitio de unión a ATP y cadenas laterales de los aminoácidos que interaccionan con el ATP.
Mecanismo de acción
Por el momento, se conocen dos aspectos muy relevantes sobre el mecanismo de acción de la Hsp90. Por una parte, se sabe que esta chaperona no actúa sola, sino que forma parte de distintos complejos proteicos que se forman
secuencialmente junto con otras cochaperonas como p23/Sba1 , o la cochaperona p50 . Por otra parte, como ya se ha mencionado, se sabe que la actividad de Hsp90 depende de la unión a ATP y posterior hidrólisis,
que induce la formación de una “pinza molecular” vía dimerización transitoria de sus dominios N-terminal. Debido a que la proteína es capaz de catalizar la hidrólisis de ATP a ADP, tiene una naturaleza enzimática de ATPasa que
resulta necesaria para la activación de sus proteínas diana. El mecanismo de acción de esta chaperona constituye un ciclo en el que se van sucediendo cambios conformacionales en su estructura terciaria como consecuencia de la unión
a ATP y la actividad ATPásica. Cuando la proteína se encuentra en su forma inactiva, tiene una conformación abierta, en la que los dominios N-terminal de las subunidades se encuentran separados y no interaccionan; esta
estructura es similar a la de una pinza abierta, como se observa en el siguiente modelo correspondiente a Hsp90 de Escherichia coli.
Configuración abierta de Hsp90 de E.coli.
En la zona superior de los brazos que constituyen la pinza, se encuentra el sitio de unión del ATP, visto en los dos modelos anteriores. La unión del ATP a Hsp90 induce un cambio conformacional de modo que la tapa del dominio N se cierra. Para pasar a
su forma activa, los monómeros individuales se aproximan para formar una estructura compacta y se enrollan entre sí de forma similar a una pinza al cerrarse, constituyéndose el dímero Hsp90 en su conformación cerrada (se
pueden comparar los modelos de las estructuras abierta y cerrada). Esta conformación es necesaria para que se produzca la hidrólisis del ATP. Tras la hidrólisis, los dominios N se disocian, volviendo a la conformación abierta,
estableciéndose un ciclo de hidrólisis o actividad ATPásica de Hsp90.
La molécula sustrato, es decir, la proteína que se tiene que plegar, se une en el dominio intermedio a la vez que se une el ATP a su sitio de unión en el dominio N-terminal; una vez la Hsp90 ha adquirido su forma activa, se
produce la hidrólisis del ATP. La propia hidrólisis induce la separación de los dominios N-terminal del dímero y el regreso a la forma inactiva liberando el sustrato activado y el ADP + Pi. El paso entre las dos configuraciones de
la proteína ocurre a través de estados intermedios.
El ciclo ATPasa y la activación de las proteínas Hsp90-dependientes ocurre gracias a una formación secuencial de complejos en los que se va asociando con distintas cochaperonas que actúan como andamiaje para la interacción con las proteínas diana, o como
reguladores de los cambios conformacionales de la proteína que favorecen o impiden el proceso. Cada uno de los reguladores se une cuando la Hsp90 se encuentra en una determinada conformación, es decir, no se pueden unir en cualquier
parte del ciclo y, por lo tanto, su actividad reguladora se da en un punto concreto del mismo. Dentro de los reguladores podemos destacar a p23 que estabiliza el dímero previamente a la hidrólisis
del ATP, o CDC37 y HOP que inhiben la hidrólisis, actuando los tres como reguladores negativos. Por otra parte, está AHA1 que favorece la hidrólisis actuando en este caso como regulador positivo. Estos reguladores se unen al dominio intermedio de la chaperona, al que como hemos visto, se une también el sustrato, y son claves para el correcto funcionamiento del sistema Hsp90. En la siguiente figura podemos ver el ciclo ATPasa de Hsp90 junto con la intervención de algunos
de los factores con los que interacciona la proteína en cada parte del ciclo.
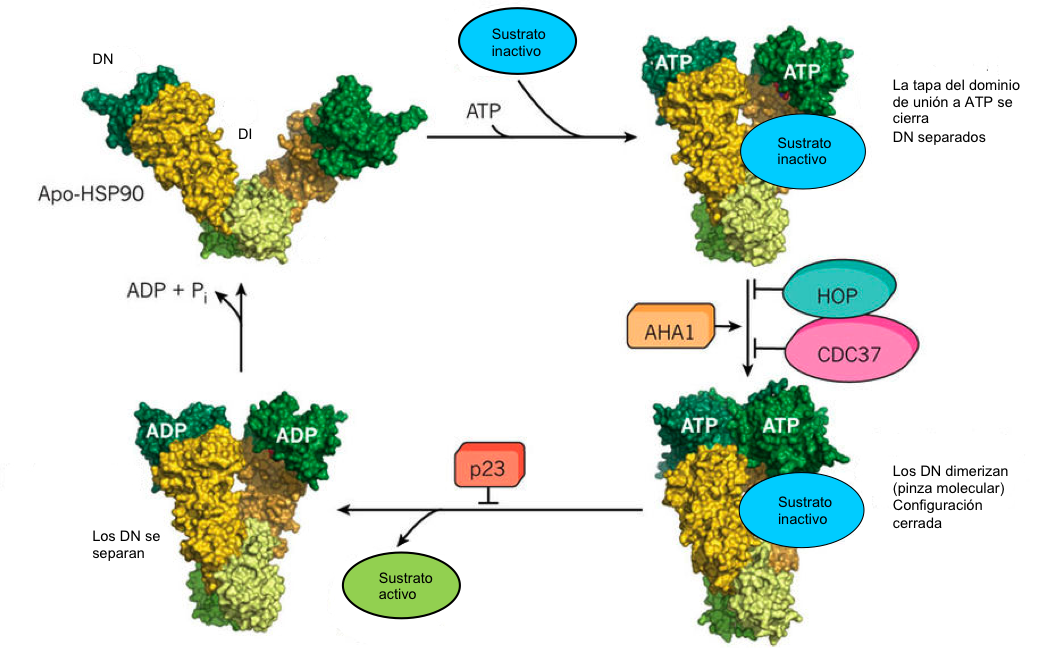 Figura 2:Cambios conformacionales de Hsp90 a lo largo del ciclo y unión de diferentes reguladores. ND, dominio N-terminal; NI, dominio intermedio; DC, dominio C-terminal. Adaptado de Hartl et al., 2011.
Figura 2:Cambios conformacionales de Hsp90 a lo largo del ciclo y unión de diferentes reguladores. ND, dominio N-terminal; NI, dominio intermedio; DC, dominio C-terminal. Adaptado de Hartl et al., 2011.
La interacción de Hsp90 con las diferentes cochaperonas es la parte más desconocida de su funcionamiento, pues, a pesar de que se han identificado varios sitios de unión a otras proteínas y se ha conseguido cristalizar la estructura
de varios complejos con cochaperonas como p50, aún no se conoce completamente cómo se produce esta asociación y qué le aporta en concreto al mecanismo de acción. No obstante, sí que se ha demostrado que la interacción con cochaperonas
es indispensable para el buen funcionamiento del sistema. De hecho, algunos de los posibles agentes quimioterápicos dirigidos a inhibir la acción de Hsp90 actúan como inhibidores competitivos de la unión de la chaperona con otras cochaperonas.
Hsp90 y el cáncer
Varios de los sustratos de la chaperona Hsp90 son proteínas involucradas en el crecimiento y la señalización que tienen un papel importante en el desarrollo de tumores, como ErbB2, Cdk4, B-Raf y la proteína kinasa B.
Además, como ya se ha mencionado, las células cancerígenas dependen de Hsp90 en mayor medida que las células sanas, por lo que la inhibición de Hsp90 se plantea como una posible terapia anticáncer.
Uno de los fármacos utilizados con este fin es la geldanamicina, una macromolécula cíclica descubierta por primera vez como metabolito secundario de Streptomyces higroscopicus. Esta molécula ocupa el sitio de unión de
ATP inhibiendo la actividad ATPásica de la chaperona. La unión de la geldanamicina impide los cambios conformacionales necesarios para el correcto funcionamiento de Hsp90 vistos en los apartados anteriores y provoca la agregación de
complejos de Hsp90 y proteínas sin plegar. Esto estimula al sistema ubiquitina proteosoma, que finalmente degrada las proteínas, y la ausencia de estas interfiere con la correcta señalización intracelular, lo que termina con
la muerte de la célula cancerígena.
Por desgracia, la geldanamicina es demasiado tóxica para su uso como fármaco, pero actualmente se están desarrollando análogos como la tanespimicina o la alvespimicina. Estos análogos son compuestos derivados de la geldanamicina
con diferentes sustituyentes en la posición 17, lo que los hace menos tóxicos.
En la siguiente estructura se puede observar el dominio N-terminal de Hsp90, con la tapa en
verde, unido a geldanamicina (en
morado) ocupando el sitio de unión a ATP.
Dominio N-terminal de Hsp90 unido a Geldanamicina que ocupa el sitio de unión a ATP.
Guion elaborado por Marta Mira Osuna, Ángel Monsalve Fernández, David Revuelta García y Óscar San José Rodríguez, alumnos de Química e Ingeniería de Proteínas, 3er curso del Grado en Biotecnología, curso 2017/18.
Cuestiones
Responder al cuestionario correspondiente en la página de Studium
Referencias
Ali, M. M., Roe, S. M., Vaughan, C. K., Meyer, P., Panaretou, B., Piper, P. W.,Prodromou, C. & Pearl, L. H. (2006). Crystal structure of an Hsp90–nucleotide–p23/Sba1 closed chaperone complex. Nature, 440(7087), 1013-1017.
Goodsell D., RCSB PDB Molecule of the Month doi:10.2210/rcsb_pdb/mom_2008_12
Hartl, F. U., Bracher, A., & Hayer-Hartl, M. (2011). Molecular chaperones in protein folding and proteostasis. Nature, 475(7356), 324-332.
Meyer, P., Prodromou, C., Hu, B., Vaughan, C., Roe, S. M., Panaretou, B., Piper, P.W. & Pearl, L. H. (2003). Structural and functional analysis of the middle segment of hsp90: implications for ATP hydrolysis and client protein
and cochaperone interactions. Molecular cell, 11(3), 647-658.
PDB www.rcsb.org, H.M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) The Protein Data Bank URL: Nucleic Acids Research, 28: 235-242.
Wandinger, S. K., Richter, K., & Buchner, J. (2008). The Hsp90 chaperone machinery. Journal of Biological Chemistry, 283(27), 18473-18477.