Introducción
La insulina humana es una hormona de naturaleza proteica. Se sintetiza en las células beta de los islotes de Langerhans del páncreas. La insulina es secretada en respuesta a la hiperglucemia y también ante algunas hormonas peptídicas
como glucagón, colecistoquinina-pancreozimina y secretina. Sus acciones principales son estimular la captación de glucosa en varios tipos de células, y disminuir el nivel de glucosa sanguínea, al estimular la conversión de glucosa
en glucógeno en los hepatocitos y miocitos, siempre que aumente dicho nivel.
Este polipéptido en su forma activa está compuesto por 51 aminoácidos. Las células de nuestro organismo, sin embargo, tienen dificultades para hacer que proteínas tan pequeñas se plieguen correctamente en estructuras estables.
Esto se soluciona mediante la síntesis de una proteína más grande de la que posteriormente se escindirá una parte.
Se traduce el mRNA de la insulina como un precursor de una única cadena polipeptídica llamado preproinsulina de 110 aminoácidos. La eliminación de su péptido de señal durante la inserción en el retículo endoplasmático
da lugar a la proinsulina de 87 residuos. La proinsulina se modifica en el aparato de Golgi y las vesículas secretoras que salen del complejo mencionado contienen la hormona activa: la insulina.
La proinsulina presenta tres dominios que se muestran en el siguiente modelo:
● Una cadena de la amino-terminal
B con una
alfa-hélice (verde)
● Una cadena carboxiterminal
A: con
dos alfa hélices (azul)
● Un péptido que conecta ambas conocido como el
péptido C (naranja)
 Dominios de la proinsulina
Dominios de la proinsulina
Una proteasa específica rompe la molécula, que se disocia como péptido C, dejando el péptido amino terminal
B unido por un puente disulfuro al péptido carboxiterminal
A que se puede observar en el modelo siguiente:
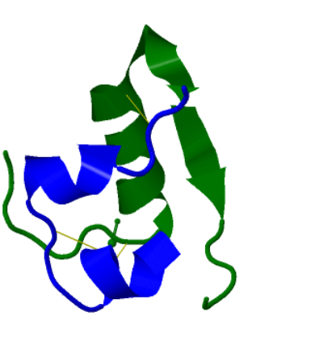 Cadenas de la insulina
Cadenas de la insulina
Receptor de insulina
La insulina después de unirse provoca la activación de un receptor que pertenece a la clase de receptores de superficie celular con actividad tirosina quinasa intrínseca. Se trata de una heterotetrámero que se sintetiza como una única cadena y es escindida
en dos partes formando una subunidad α y una subunidad β (en azul claro y morado en la imagen 1). Se insertan dos subunidades extracelulares α unidas entre sí por puentes disulfuro y dos subunidades β. Ambos tipos de subunidades
son glicoproteínas cuya parte glucídica juega un importante papel en la afinidad por la insulina. En el polipéptido α está el sitio de unión a insulina y el β posee un dominio extracelular, un dominio transmembrana y un dominio
intracelular con la actividad tirosina quinasa. Este último dominio se autofosforila y fosforila otras proteínas, activando así la cascada de señalización. El receptor puede unir 2 moléculas de insulina.
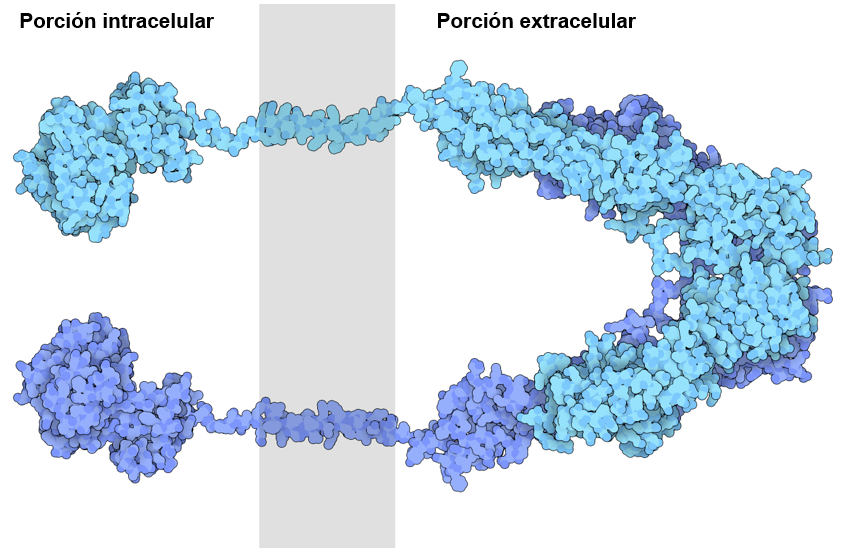 Imagen 1. Receptor de insulina. Tomada de Goodshel, 2016.
Imagen 1. Receptor de insulina. Tomada de Goodshel, 2016.
En la forma activada del dominio tirosina quinasa podemos ver un
lazo flexible (verde) que incluye
tres tirosinas (rosa) las cuales están
fosforiladas (rojo) cuando el receptor está activado. Un péptido corto mimético del sustrato (azul) con una tirosina se une al sitio activo y es fosforilado en ésta por el
ATP (rojo) alojado en este bolsillo.
 Dominio tirosina quinasa del receptor de la insulina.
Dominio tirosina quinasa del receptor de la insulina.
Estructura de la insulina
La insulina es un ejemplo típico de proteína globular en la que encontramos los aminoácidos no polares en el centro formando un núcleo hidrofóbico y los aminoácidos polares y cargados en torno a éste. Se trata de una estructura muy
conservada entre especies. Tal es el caso que la insulina humana solo se diferencia en un aminoácido con la insulina de cerdo. En la siguiente imagen observamos los
residuos hidrofóbicos en blanco,
los polares sin carga en verde y los
cargados positiva o negativamente en rojo. Así mismo observamos la
Thr30 en azul
que es el aminoácido que cambia con respecto al cerdo (este animal presenta una Alanina en dicho lugar). Viendo su localización en la estructura podemos interpretar que no supone un cambio significativo ya que está en un extremo, la única diferencia es
en cuanto a la solubilidad que aumenta en el caso de los humanos al tratarse de un aminoácido polar que puede formar puentes de hidrógeno con el agua.
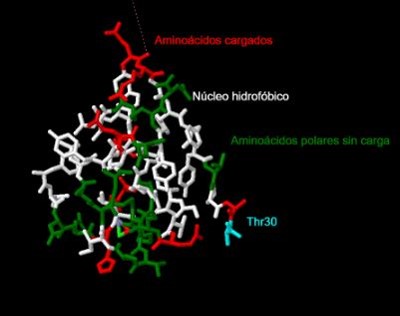 Estructura de la insulina humana.
Estructura de la insulina humana.
Aspectos estructurales
Como se ha visto en la introducción, la insulina es una proteína que está constituida por dos cadenas: la cadena A de 21 aminoácidos, y la cadena B de 30 aminoácidos. Ambas cadenas interaccionan mediante dos puentes disulfuro
entre las posiciones (7 y 7 de las dos cadenas, y entre posiciones 19 de una y 20 de la otra y también existe un puente disulfuro interno en la cadena A, entre los residuos 6 y 11.
En la siguiente imagen se muestran la secuencia primaria de las cadenas representadas de forma esquemática, con las cadenas y los puentes disulfuro entre ellas.
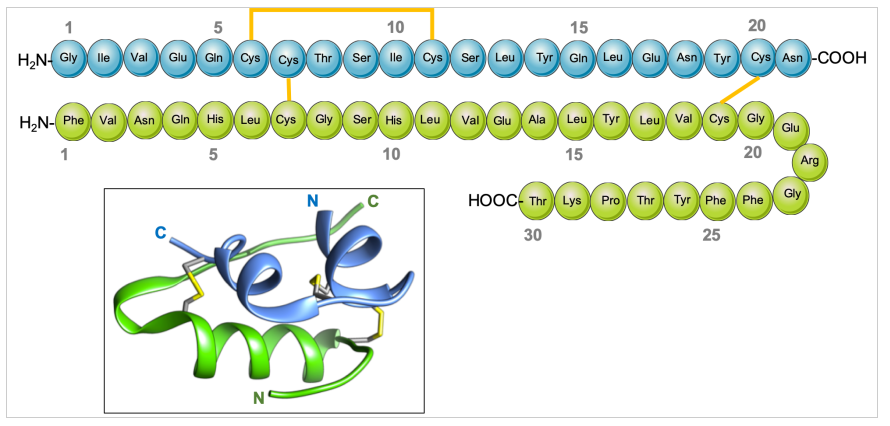 Imagen 2. Estructura esquemática de la insulina (secuencia primaria). La cadena A se muestra en azul, la B en verde y los puentes disulfuro en amarillo. En el recuadro se muestra la estructura 3D. Tomado de Patel of Dutta 2018.
Imagen 2. Estructura esquemática de la insulina (secuencia primaria). La cadena A se muestra en azul, la B en verde y los puentes disulfuro en amarillo. En el recuadro se muestra la estructura 3D. Tomado de Patel of Dutta 2018.
En cuanto a la estructura secundaria de la cadena A: la estructura predominante es la helicoidal, que representa el 57%, con dos modalidades de la misma, hélice alfa en los residuos 2-6 y 13-16 y hélice 3/10 en residuos
16-19, todos incluidos. Uno de los residuos, el de cisteína (C20) representa un elemento en beta (puente). Además, observamos el puente disulfuro interno entre las cisteínas 6-11 y zonas en las que no hay una estructura secundaria
definida. Observamos también un giro entre aminoácidos 6 y 8.
En cuanto a la estructura de la cadena B: En esta cadena también encontramos una mayoría helicoidal (14 residuos del 9 al 22 incluidos) con mayoría en alfa, aunque también alguna 3/10. Tres residuos son hebra beta y una
parte de la secuencia es sin estructura secundaria. Esta cadena posee un sitio de unión al ion zinc en el residuo de histidina de la posición 10. Hay una curva en el residuo 4.
A continuación, se muestra el modelo de la insulina mostrándose el tipo de estructura secundaria de cada fragmento proteico.
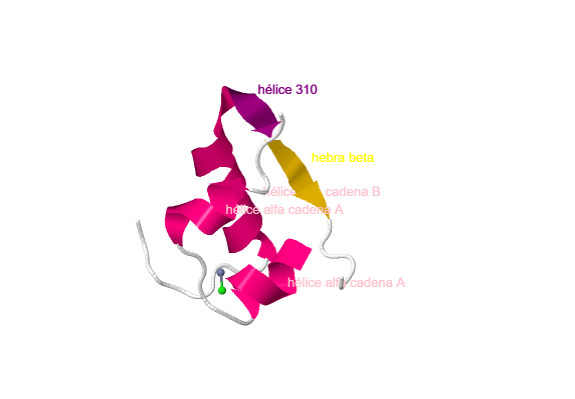 Insulina, estructuras secundarias.
Insulina, estructuras secundarias.
En cuanto a los puentes disulfuro que unen las dos cadenas, se encuentran como ya se ha dicho entre las posiciones 7 de la cadena A y la 7 de la cadena B; y entre las posiciones 20 A y 19 B. Estos puentes entre cisteínas de ambas cadenas permiten estabilizar
la estructura del dominio. En la siguiente imagen, se muestran marcadas las cisteínas de las cadenas de la insulina y en amarillo los puentes disulfuro, tanto los que unen ambas cadenas, como el intracatenario de la cadena A.
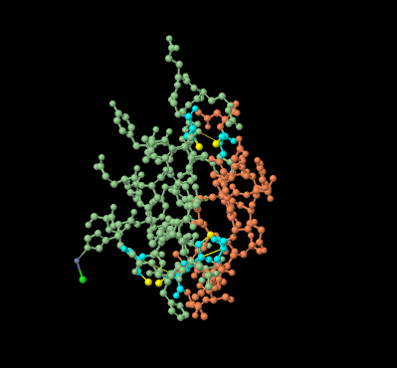 Detalle de los puentes disulfuro de la insulina.
Detalle de los puentes disulfuro de la insulina.
Conformaciones tridimensionales
La insulina puede adoptar tres conformaciones diferentes que vienen determinadas por la disposición tridimensional del extremo N-terminal de la cadena B, el cual es bastante flexible permitiendo intercambiarse entre los distintos
estados. En primer lugar, puede adoptar una disposición helicoidal prolongando la hélice ya existente formando una larga en conformación relajada (R). Por otra parte, los residuos de dicho extremo pueden no presentar una estructura
secundaria definida y se disponen en una estructura extendida en conformación tensa (T). La otra variante es una mezcla de las dos que contiene dos residuos extendidos y el resto formando una hélice (Rf). En la siguiente imagen,
cadena A: azul,
cadena B: verde .
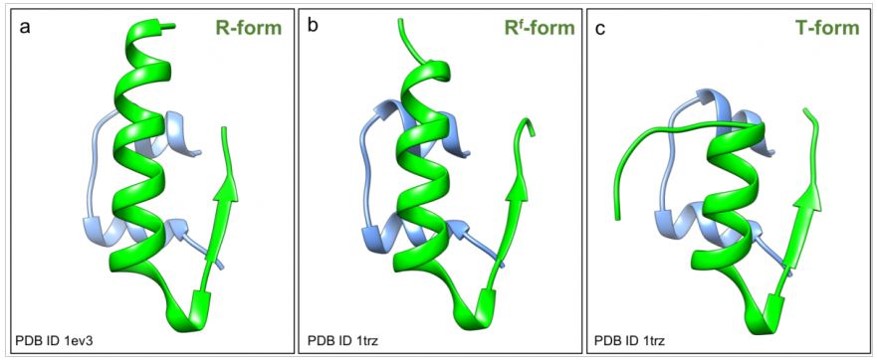 Imagen3. Conformaciones tridimensionales de la insulina. se indican los códigos PDB de las estructuras. Tomada de Patel & Dutta, 2018.
Imagen3. Conformaciones tridimensionales de la insulina. se indican los códigos PDB de las estructuras. Tomada de Patel & Dutta, 2018.
El
extremo N-terminal no es el único flexible, ya que el
C-terminal de la cadena B también es variable adoptando diversas posiciones que le permiten al monómero de insulina el ensamblaje con otro adyacente, la formación de un hexámero y la unión con el receptor.
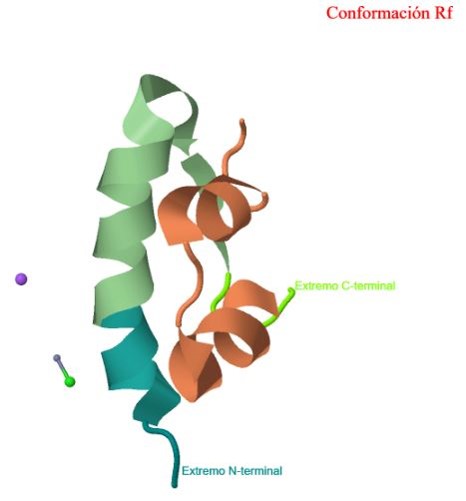 Conformación RF
Conformación RF
Agrupaciones oligoméricas
Una vez sintetizada en las células β pancreáticas, la insulina se almacena en forma de hexámeros que a su vez forman microcristales que se almacenan en gránulos secretores, de los que son liberados posteriormente. De esta forma
se facilita el almacenamiento y se previene la temprana degradación. La asociación en hexámeros es una de las bases de las insulinas recombinantes para aumentar su vida media en el organismo.
Como vimos anteriormente, el monómero de insulina puede encontrarse en tres estados conformacionales, lo que explica que haya una gran variedad de hexámeros diferentes coexistiendo que combinan insulinas en todos los estados.
Los más estudiados son los
todo tenso (T6, c en la siguiente imagen), todo relajado (R6 o Rf6, a en la imagen 4) o mitad tensa mitad relajada (T3R3, b en la imagen 4). Las formas y las propiedades de la superficie
de estos tres tipos de hexámeros de insulina son distintas entre sí.
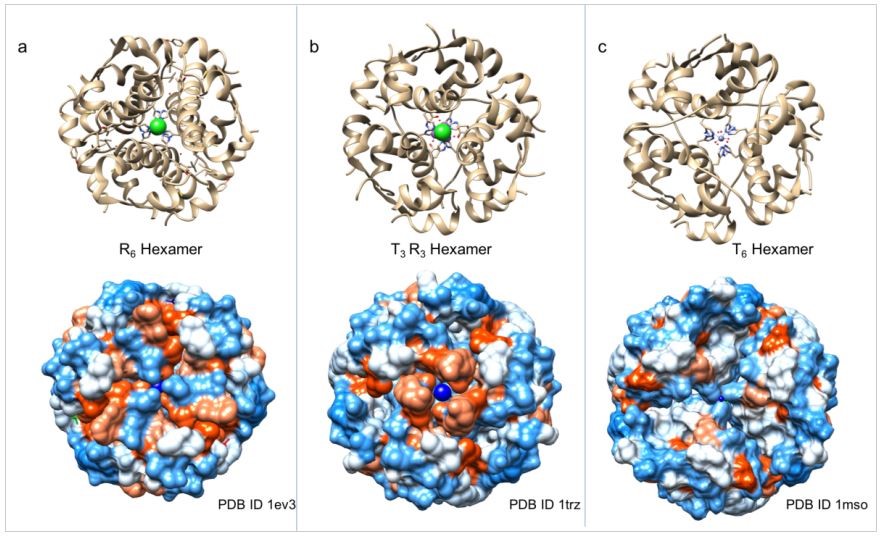 Imagen 4. agrupaciones hexaméricas de la insulina, representados en lazos (panel superior) y superficie (panel inferior, naranja superficie hidrofóbica, azul idrofílica). se indican los códigos PDB de las estructuras. Tomado de Patel & Dutta, 2018
Imagen 4. agrupaciones hexaméricas de la insulina, representados en lazos (panel superior) y superficie (panel inferior, naranja superficie hidrofóbica, azul idrofílica). se indican los códigos PDB de las estructuras. Tomado de Patel & Dutta, 2018
En el centro de estos hexámeros encontramos tres átomos de
sodio
(morado) estabilizados mediante puentes salinos con residuos de
glutámico (rojo) de las cadenas B de las insulinas
(Glu13). Los tres átomos de
Na interaccionan con un total de seis
glutámicos. Lo que de verdad mantiene la estructura son las estructuras formadas en torno al
zinc (naranja) . Se trata de dos átomos de
Zn que se encuentran entre los monómeros de insulina. Cada átomo de
Zn
presenta cuatro enlaces, uno con otro átomo de
cloro (verde) y otros tres con residuos de
Histidina (His10, en azul) de las cadenas B de los monómeros.
Cadenas B: marrón.
Cadenas A: azul claro.
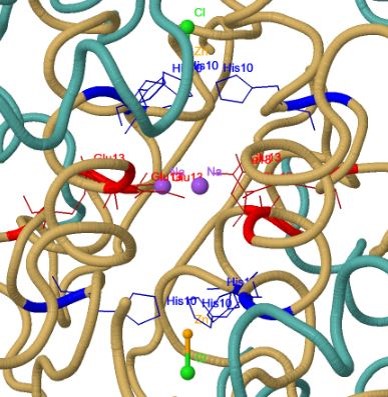 Interacciones en el centro de los hexámeros.
Interacciones en el centro de los hexámeros.
Se cree que en sangre estos hexámeros pueden viajar, aunque se disocian rápido en formas más simples como dímeros que pueden difundir por las zonas intercelulares. Cuando llegan al lugar de acción se vuelven a disociar a monómeros
(si no lo han hecho ya) cuya forma es la verdaderamente activa y se une a su receptor.
Patologías asociadas a defectos en la insulina
Diabetes mellitus
La diabetes mellitus (DM) engloba un grupo de enfermedades metabólicas caracterizadas por hiperglucemia crónica debida a un defecto en la secreción y/o en la acción de la insulina endógena. Distinguimos varios tipos de diabetes:
· Diabetes tipo 1 o insulin-dependent diabetes mellitus (IDDM): se caracteriza por destrucción o pérdida de las células beta pancreáticas, generalmente debido a mecanismos autoinmunes, provocando una deficiencia progresiva (y finalmente total) de insulina.
Estos pacientes necesitan ser complementados con las inyecciones de la insulina del exterior.
· Diabetes tipo 2 o non insulin-dependent diabetes mellitus (NIDDM): es causada por resistencia a la insulina o deficiencia en la producción de la misma por parte de las células beta pancreáticas. Se relaciona con obesidad
y con inactividad física, además de otros factores ambientales y de la susceptibilidad genética del individuo.
· Diabetes gestacional (DMG): a medida que avanza el tiempo durante la gestación, la sensibilidad tisular a la insulina tiende a disminuir. La diabetes mellitus gestacional ocurre cuando la secreción de insulina no es suficiente
para compensar la disminución en los niveles de sensibilidad a ésta, de forma que se produce una deficiencia relativa de su acción, lo que presenta efectos patológicos.
Insulinoma
Es la neoplasia más frecuente del grupo de tumores neuroendocrinos de páncreas. Se desarrollan dichos tumores en las células beta pancreáticas, lo que lleva a un exceso de la producción de insulina. Esto da lugar a hipoglucemia que tiene efectos a nivel
sistémico.
Síndrome metabólico
El síndrome metabólico es un grupo de afecciones que suponen un riesgo de desarrollar una enfermedad cardíaca y diabetes tipo 2, como la hipertensión arterial, hiperglucemia o niveles elevados de triglicéridos. Se ha sugerido que el origen esté mayoritariamente
en la resistencia a insulina (entre otros factores), lo que genera un entorno metabólico favorable para el desarrollo de dicha enfermedad, aunque existe cierta controversia.
Diseño de insulinas recombinantes
Antiguamente, las personas que sufrían de diabetes mellitus no tenían ningún tratamiento para controlar su nivel de azúcar. Con el descubrimiento y obtención de la insulina, se pudo mejorar la vida de estos pacientes. En origen, se extraía esta insulina
de otras especies, como el cerdo, pero hoy en día se genera mediante bacterias modificadas biotecnológicamente que producen insulina humana. La insulina recombinante humana actúa tras inyectarse bajo la piel disminuyendo los niveles
de glucosa en sangre, pero tiene el inconveniente de una vida media demasiado corta. Por este motivo, tras la aprobación de la insulina recombinante se ha estado trabajando en una insulina de acción prolongada.
Como ya se ha comentado, la insulina se almacena en el páncreas en forma de hexámero y al liberarse a la sangre es cuando se forma el monómero activo, que será el que se una al receptor de insulina, que se encuentra presente en la superficie de la mayoría
de células. La manera de hacer una insulina de larga duración es ralentizar la transformación en el monómero activo. En inicio se realizó uniendo la insulina a proteína de pez (protamina), lo que permitía formar un complejo que se
disuelve lentamente en sangre, y después modificando la insulina añadiendo dos argininas en el Cterm de la cadena B y cambiando una asparagina por una glicina en la posición 21 de la cadena A. El resultado es la glargina, una insulina
de larga duración que es menos soluble en sangre (se modifica el punto isoeléctrico de un pH de 5,4 a 6,7) y prolonga la transformación a monómero activo.
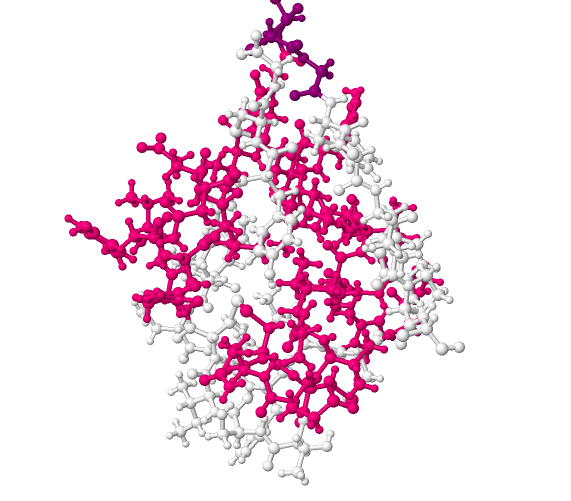 Estructura de la insulina recombinante glargina.
Estructura de la insulina recombinante glargina.
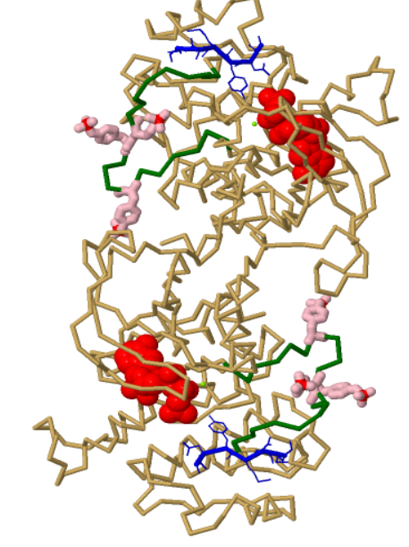
La insulina también se estabiliza añadiendo cadenas hidrocarbonadas a la hormona, concretamente al extremo C-term de la cadena B, que unen varios hexámeros permitiendo ralentizar la disolución en un monómero activo. Esas cadenas también estabilizan la
unión con la proteína plasmática seroalbúmina, lo cual extiende la acción de la insulina recombinante. La forma resultante se denomina degludec.
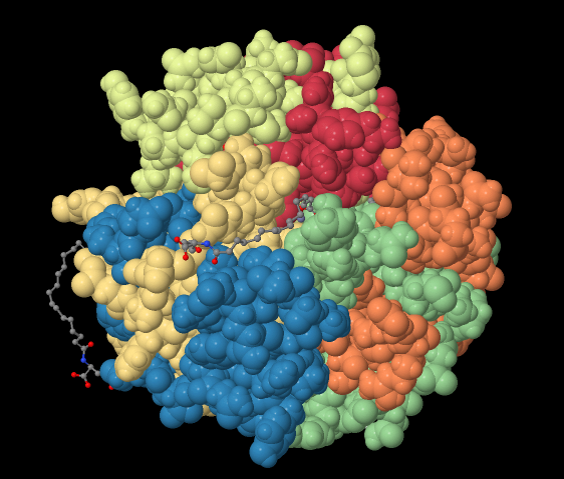 Estructura de la insulina recombinante degludec (insulina acilada).
Estructura de la insulina recombinante degludec (insulina acilada).
En este último enlace mostrado podemos observar las subunidades del hexámero en colores diferentes y las cadenas hidrocarbonadas que encontramos en degludec uniendo subunidades. A continuación, un esquema de esta forma de insulina recombinante en
el que se muestran dos hexámeros unidos mediante grupos acilo.
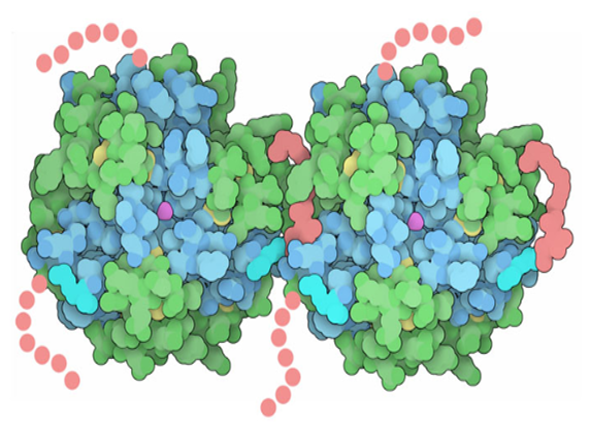 Figura 5. Imagen de dos hexámeros de degludec. En rosa se muestran las largas cadenas hidrocarbonadas unidas a la cadena B. Tomado de Goodsell, 2016.
Figura 5. Imagen de dos hexámeros de degludec. En rosa se muestran las largas cadenas hidrocarbonadas unidas a la cadena B. Tomado de Goodsell, 2016.
La insulina de acción prolongada se combina con insulina de acción rápida. Esta insulina recombinante se consigue desestabilizando el hexámero, de tal manera que se convierte más rápidamente en monómero activo en la sangre. La primera insulina recombinante
de acción rápida se denomina lisipro (Humalog ®), cuya modificación es el orden de dos aminoácidos cercanos al extremo C-terminal de la cadena B. Añadiendo aminoácidos cargados en esa localización también se consigue el objetivo.
Guion elaborado por Elisa Armenteros Aragón, Pablo Buján Costas, Sergio García Sánchez y Jesús López Rivera, alumnos de Química e Ingeniería de Proteínas, 3er curso del Grado en Biotecnología, curso 2019/20.
Cuestiones
Responder al cuestionario correspondiente en la página de Studium
Referencias
- Alberti, K.G., Eckel, R.H., Grundy, S.M., Zimmet, P.Z., Cleeman, J.I., Donato, K.A., et al. (2009) Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology
and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 120(16):1640-5.
- Goodsell, D. (2001a) a RCSB PDB Molecule of the Month doi:10.2210/rcsb_pdb/mom_2001_2
- Goodsell, D. (2001b) RCSB PDB Molecule of the Month doi: 10.2210/rcsb_pdb/mom_2015_2
- Goodsell, D. (2016) RCSB PDB Molecule of the Month doi:10.2210/rcsb_pdb/mom_2016_2
- Kautzky-Willer, A. & Bancher-Todesca, D. (2005) Endocrine changes in diabetic pregnancy. Diabetology of pregnancy. Front Diabetes. Basel, Karger. 17:18-33.
- PDB www.rcsb.org, H.M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) The Protein Data Bank URL: Nucleic Acids Research, 28: 235-242.
- Reaven, G.M. (1988). Banting lecture 1988. Role of insulin resistance in human disease. Diabetes 37(12):1595-607
- Tucker, O.N., Crotty, P.L. & Conlon, K.C (2006). The management of insulinoma. Br J Surg 93: 264-75.















