Introducción
Las cristalinas, como da a entender su nombre, son las proteínas estructurales predominantes en el cristalino del ojo. Son proteínas solubles en agua y su función principal es la de contribuir a la transparencia y a las propiedades
reflectantes del cristalino, formando una solución concentrada uniformemente en el interior de sus células. Éstas son alargadas, anucleadas y no presentan mitocondrias.
Existen varios tipos de cristalinas, que se asocian en diferentes estructuras estables y resistentes. En humanos, las principales son las α, β, y γ cristalinas:
- Las α cristalinas son las más comunes y aparecen formando grandes agregados, que contienen dos tipos de subunidades relacionadas, A y B. Estas son muy similares a la familia de las small heat shock proteins (sHsp), por lo
que además de su función estructural, presentan actividad también como chaperonas. Este es un factor relevante en la formación de cataratas, ya que las cristalinas se deterioran con la edad, formando agregados opacos y, finalmente,
manifestando esta patología.
- Las β cristalinas también forman complejos, que son distintos según el tipo de subunidades que se asocien, ya que son muy variadas. Generalmente, están compuestas por dos dominios similares unidos por un pequeño péptido, conformados
a su vez por dos motivos parecidos. Cada motivo se encuentra plegado con un patrón distintivo de “llave griega β”.
- Las γ cristalinas están formadas por un único monómero, y también contienen motivos en llave griega. Estas cristalinas son poco abundantes, e intervienen como agente adhesivo para la agrupación de las cristalinas α.
Estas proteínas aparecen en todos los vertebrados y cumplen otras funciones más allá de la estructural. Ejemplo de ello son las δ cristalinas de pato, cristalinas de musaraña elefante y λ cristalinas de conejo,
que presentan además actividad enzimática, denominadas como moonlight proteins. Se conoce como moonlight proteins a aquellas proteínas que cumplen múltiples funciones autónomas (muchas veces no relacionadas) que no se deben
a fusiones génicas, variantes por splicing o efectos pleiotrópicos. Nos centraremos en la δ1 y δ2 cristalinas de pato, muy similares entre sí, pero mientras la δ2 cristalina funciona como enzima argininosuccinato
liasa (ASL), la δ1 cristalina ha perdido dicha actividad enzimática.
ESTRUCTURA
La estructura cuaternaria de las δ-cristalinas consiste en un tetrámero simétrico, conformado por dos dímeros constituidos a su vez por dos monómeros iguales, de 464 aminoácidos cada uno.
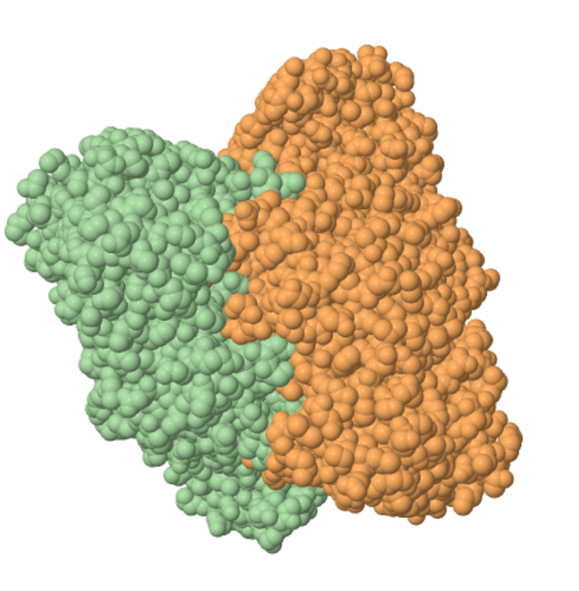 Estructura de la 1-cristalina
Estructura de la 1-cristalina
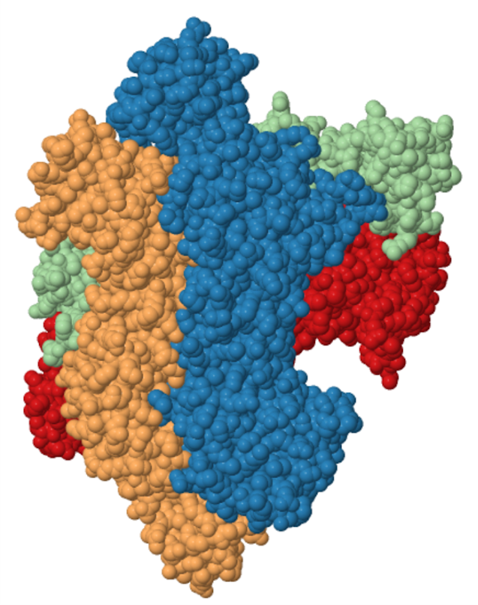 Estructura de la 2-cristalina
Estructura de la 2-cristalina
En cada uno de los monómeros de esta cristalina se pueden diferenciar 3 dominios, cuya implicación en la función de dicha proteína indicaremos en el apartado siguiente. El
dominio 1 y el
dominio 3 tienen una topología similar, estando cada dominio constituido por 2 motivos hélice-giro-hélice. El
dominio 2 central, está compuesto por 5 α-hélices largas que junto al resto de monómero forman un haz de 20 hélices en el núcleo de la proteína. El extremo
C-terminal forma una α-hélice que se empaqueta junto al dominio 2. También cabe destacar que, en ciertas zonas del monómero, la estructura secundaria no está definida y presenta giros o lazos, en los que aparecen aminoácidos
pertenecientes al centro activo y relacionados con la unión del sustrato.
La δ2-cristalina (ASL) es miembro de una superfamilia de enzimas homotetraméricas que incluyen a la fumarasa de clase II, adenilosuccinato liasa y 3-carboxi-cis, cis-muconato cicloisomerasa (CMLE). A lo largo de esta superfamilia, se han identificado tres
regiones aminoacídicas muy conservadas. Estas secuencias (C1,
C2y
C3) se disponen separados a cierta distancia en la estructura del monómero, pero se agrupan en el tetrámero para formar el sitio activo. Los dominios y regiones conservadas se pueden observar en la siguiente imagen:
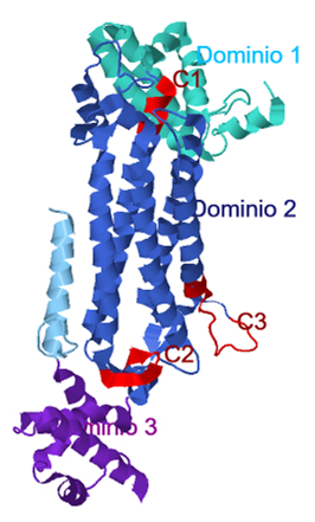 Dominios de la 2-cristalna
Dominios de la 2-cristalna
Uno de los aspectos más destacables de las cristalinas δ1 y δ2 de pato, es que entre ambas existe un
94% de similitud de aminoácidos. Además, sabemos que los centros activos de ambas proteínas son idénticos, y es aquí donde reside la particularidad más interesante de estas proteínas, ya que, a pesar de que los centros activos
de ambas no varían entre sí, sabemos que la δ2 posee capacidad catalítica, mientras que δ1 no. Esto nos indica que la pequeña diferencia que existe entre ambas cristalinas es determinante para la función de las mismas, aún no afectando
esta diferencia al centro activo.
FUNCIÓN Y CENTRO ACTIVO
En la siguiente imagen se resume la reacción que es catalizada por esta enzima:
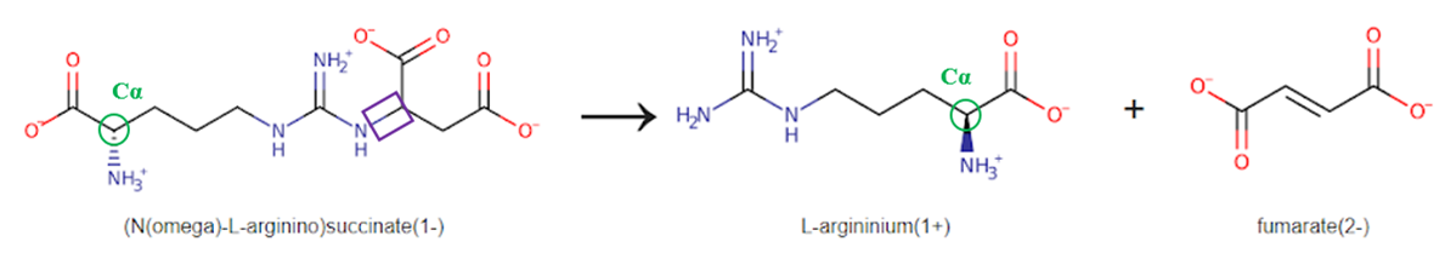 Reacción catalizada por la2-cristalina
Reacción catalizada por la2-cristalina
Como se ha mencionado anteriormente, la δ2-cristalina en patos funciona como enzima arginino succinato liasa. Esta enzima cataliza la rotura de argininosuccinato en arginina y fumarato, empleando para ello un mecanismo ácido/básico. Un residuo de histidina
se encarga de captar un protón del
carbono alfa del sustrato dando lugar a un intermediario carbanión. A continuación, se forma otro intermediario, en este caso es un carbanión (carboxilato) que se genera por la redistribución de la carga negativa hacia un grupo
carboxilo. Uno de los dos intermediarios formados proporciona la energía para llevar a cabo la expulsión del grupo fumarato. El mecanismo ácido/básico ayuda a la rotura de la
unión C-N terminal por medio de la donación de un protón al nitrógeno del grupo guanidino del argininosuccinato. La reacción es estereoespecífica, por lo que son necesarios dos grupos separados para captar y donar el protón.
El bucle 280, comprendido entre los residuos 280 y 294, dentro de la región
C3, está estrechamente relacionado con el mecanismo catalítico, ya que contiene 2 aminoácidos clave para la actividad enzimática, y por su localización e interacción con otros monómeros, permite la formación del centro activo
en la interfaz entre dos monómeros. Así pues, la δ2-cristalina presenta cuatro centros activos:
 Detalle de los centros activos de laδ2-cristalina
Detalle de los centros activos de laδ2-cristalina
Por medio de estudios estructurales y bioquímicos se ha visto que la
Ser-281 y la
His-160 están implicados como ácido catalítico y base respectivamente en la reacción de la ASL/δ2-cristalina. La cadena lateral de
Lys-287, cargada positivamente, ayuda a estabilizar las cargas negativas de los intermediarios durante la catálisis. Por otro lado, se ha propuesto que el
Glu-294 sea el residuo que funcione cómo “relé”, estabilizando la
His-160 catalítica. Es importante destacar que, los dos aminoácidos del bucle 280 (Ser-281, Lys-287) y Glu-294 pertenecen a una cadena, mientras que la His-160 pertenece a la cadena enfrentada a la anterior, como se puede observar
en la imagen inferior, en la que se muestran los dos
centros
activos formados por las cadenas
A y
B:
 Detalle de los residuos importantes del centro activo de laδ2-cristalina.
Detalle de los residuos importantes del centro activo de laδ2-cristalina.
δ1 Y ACTIVIDAD ENZIMÁTICA
Las diferencias entre ambas proteínas, que llevan a que la δ1 no presente actividad catalítica, se encuentran en los 28 aminoácidos que están señalados en
naranja. Es destacable que haya 17 aminoácidos diferentes en el
dominio 1, mientras que solo
5 en el
dominio 2 y 6 en el
dominio 3:
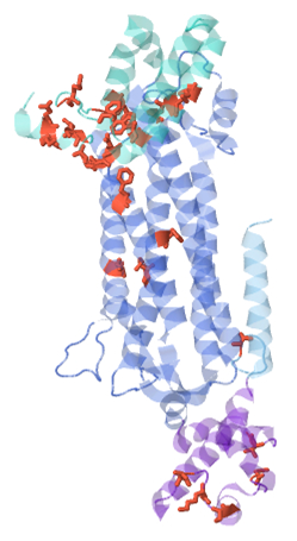 Detalle de los residuos de la δ2-cristalina no conservados en la δ1-cristalina
Detalle de los residuos de la δ2-cristalina no conservados en la δ1-cristalina
Realizando una comparación entre las secuencias primarias de los monómeros de ambas cristalinas, podemos determinar la identidad de cada uno de los residuos que difieren:
 Comparación de las secuencias de la δ1-cristalina de la δ2-cristalina
Comparación de las secuencias de la δ1-cristalina de la δ2-cristalina
En esta comparación entre la δ1 (dd1) y δ2 (dd2), se puede comprobar que el dominio 1 es en el que se encuentran mayores diferencias, que están agrupadas en determinadas regiones de la estructura secundaria. Estas regiones son el brazo N-terminal (no
mostrado) y los denominados
lazos 20s (residuos 22-31) y
70s (residuos 74-89) del dominio 1:
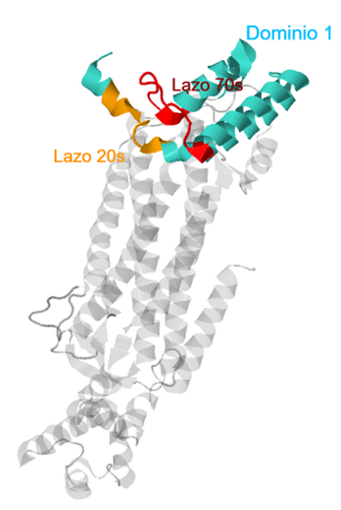 : En color se muestran las regiones de la δ2-cristalina que difieren más respecto a la δ1-cristalina
: En color se muestran las regiones de la δ2-cristalina que difieren más respecto a la δ1-cristalina
Para facilitar la visualización tanto del
centro activo, como de las
regiones conservadas,
aminoácidos diferentes y los
lazos 20s y
70s70s, se ha condensado dicha información en la siguiente estructura:
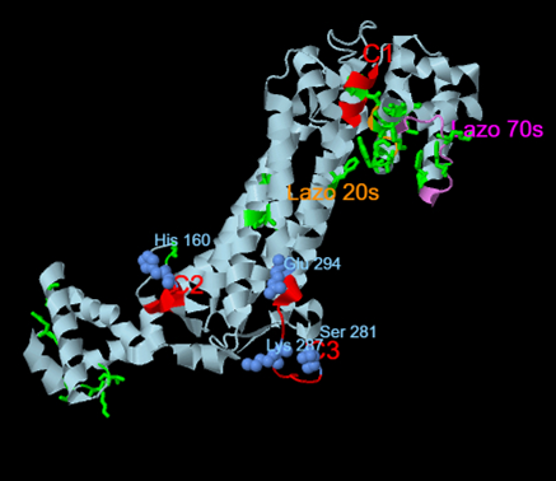 Estructura de la δ2-cristalina. En azul se muestran los residuos del centro activo. En rojo las regiones conservadas y en verde las no conservadas, respecto a la δ1-cristalina.
Estructura de la δ2-cristalina. En azul se muestran los residuos del centro activo. En rojo las regiones conservadas y en verde las no conservadas, respecto a la δ1-cristalina.
Se han realizado numerosos experimentos para entender por qué la δ1 cristalina carece de actividad ASL, mientras que δ2 cristalina si mantiene dicha actividad enzimática. En estos experimentos se certificó que los 17 aminoácidos diferentes del dominio
1 son los responsables de la función de δ2. Donde mayor variabilidad en la conformación se encuentra en los lazos 20 y 70. Se ha comprobado que, si en la δ2 cristalina se mutan los 17 residuos del dominio 1, por los mismos residuos
que aparecen en la δ1 cristalina, la proteína resultante era enzimáticamente inactiva, y aunque la estructura era similar.
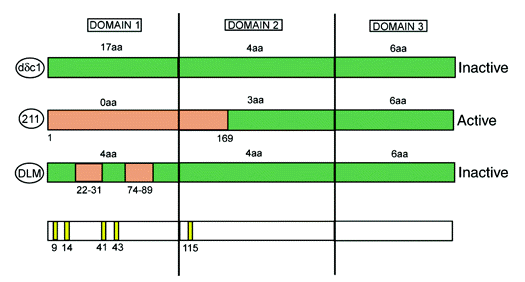 Representación esquemática de δ1-cristalina (en verde) y de dos versiones quiméricas a las que se han añadido residuos de δ2-cristalina (en naranja). Tomado de Tsai et al. (2004) Biochemistry, 43(37), 11672-11682.
Representación esquemática de δ1-cristalina (en verde) y de dos versiones quiméricas a las que se han añadido residuos de δ2-cristalina (en naranja). Tomado de Tsai et al. (2004) Biochemistry, 43(37), 11672-11682.
Otros experimentos se centraron en mutar aminoácidos concretos.
● Trp-9/Asp-115 → Met/Glu: descenso de la actividad enzimática. Preferencia por un residuo aromático en esta posición.
● Truncamiento de los primeros 8, 9 o 14 residuos N-terminales: Menor o nula actividad ASL. Son residuos cruciales para la actividad enzimática en δ2.
● Asp-115 → Otro aa: Pérdida de actividad enzimática. Interacciona con residuos relacionados con la estabilización y captación del sustrato.
Estudios cinéticos combinados con los datos estructurales sugieren que el brazo N-terminal en ASL/δ2-cristalina estabiliza las regiones de la proteína involucradas en la unión del sustrato y la catálisis, y en el secuestro completo del sustrato del solvente.
Para la liberación del producto es necesario que el brazo N-terminal se retire del sitio activo.
También se especula que la δ-cristalina de pato se ha adaptado a su función estructural adoptando una conformación
un poco menos estable que la hASL (argininosuccinato liasa humana) que puede que le confiera la capacidad de participar en interacciones proteína-proteína y proteína-solvente.
Autores
Guion elaborado por Víctor Rodriguez Gallego, Pablo Rodríguez Prieto, Daira Valencia Sánche y José Javier Vaquero González, alumnos de Química e Ingeniería de Proteínas, 3er curso del Grado en Biotecnología, curso 2019/20.
Referencias
Sampaleanu, L. M., Vallée, F., Slingsby, C., & Howell, P. L. (2001). Structural studies of duck δ1 and δ2 crystallin suggest conformational changes occur during catalysis. Biochemistry, 40(9), 2732-2742.
Sampaleanu, L. M., Davidson, A. R., Graham, C., Wistow, G. J., & Howell, P. L. (1999). Domain exchange experiments in duck δ-crystallins: functional and evolutionary implications. Protein science, 8(3), 529-537.
Tsai, M., Sampaleanu, L. M., Greene, C., Creagh, L., Haynes, C., & Howell, P. L. (2004). A duck δ1 crystallin double loop mutant provides insight into residues important for argininosuccinate lyase activity. Biochemistry,
43(37), 11672-11682.
Tsai, M., Koo, J., & Howell, P. L. (2005). Recovery of argininosuccinate lyase activity in duck δ1 crystallin. Biochemistry, 44(25), 9034-9044.
WU, C. Y., LEE, H. J., WU, S. H., CHEN, S. T., CHIOU, S. H., & CHANG, G. G. (1998). Chemical mechanism of the endogenous argininosuccinate lyase activity of duck lens δ2-crystallin. Biochemical Journal, 333(2), 327-334.
Lulli, M., Nencioni, D., Papucci, L., & Schiavone, N. (2019). Zeta-crystallin: a moonlighting player in cancer. Cellular and Molecular Life Sciences, 1-12.
Simonneau, L. I. O. N. E. L., Crisanti, P., Lorinet, A. M., Alliot, F., Courtois, Y., Calothy, G., & Pessac, B. (1986). Crystallin gene expression and lentoid body formation in quail embryo neuroretina cultures transformed
by the oncogenic retrovirus Mill Hill 2 or Rous sarcoma virus. Molecular and cellular biology, 6(11), 3704-3710.
Sullivan, C. H., Marker, P. C., Thorn, J. M., & Brown, J. D. (1998). Reliability of delta-crystallin as a marker for studies of chick lens induction. Differentiation, 64(1), 1-9.
Ozato, K., Kondoh, H., Inohara, H., Iwamatsu, T., Wakamatsu, Y., & Okada, T. S. (1986). Production of transgenic fish: introduction and expression of chicken δ-crystallin gene in medaka embryos. Cell differentiation, 19(4),
237-244.
Kannan, R., Sreekumar, P. G., & Hinton, D. R. (2016). Alpha crystallins in the retinal pigment epithelium and implications for the pathogenesis and treatment of age-related macular degeneration. Biochimica et Biophysica Acta
(BBA)-General Subjects, 1860(1), 258-268.











