PROTEÍNAS G
Las proteínas G son una familia de proteínas que pueden ser monoméricas o heterotriméricas. Estas son capaces de unirse a nucleótidos de guanina, de manera que son activas unidas a GTP hasta que lo hidrolizan a GDP, momento
en el que pasan a estar inactivas. Las proteínas G desarrollan un importante papel en la transducción de señales extracelulares como el estímulo luminoso, el glucagón, la adrenalina, etc. Estas actúan siendo importantes intermediarios
en las rutas de señalización intracelular.
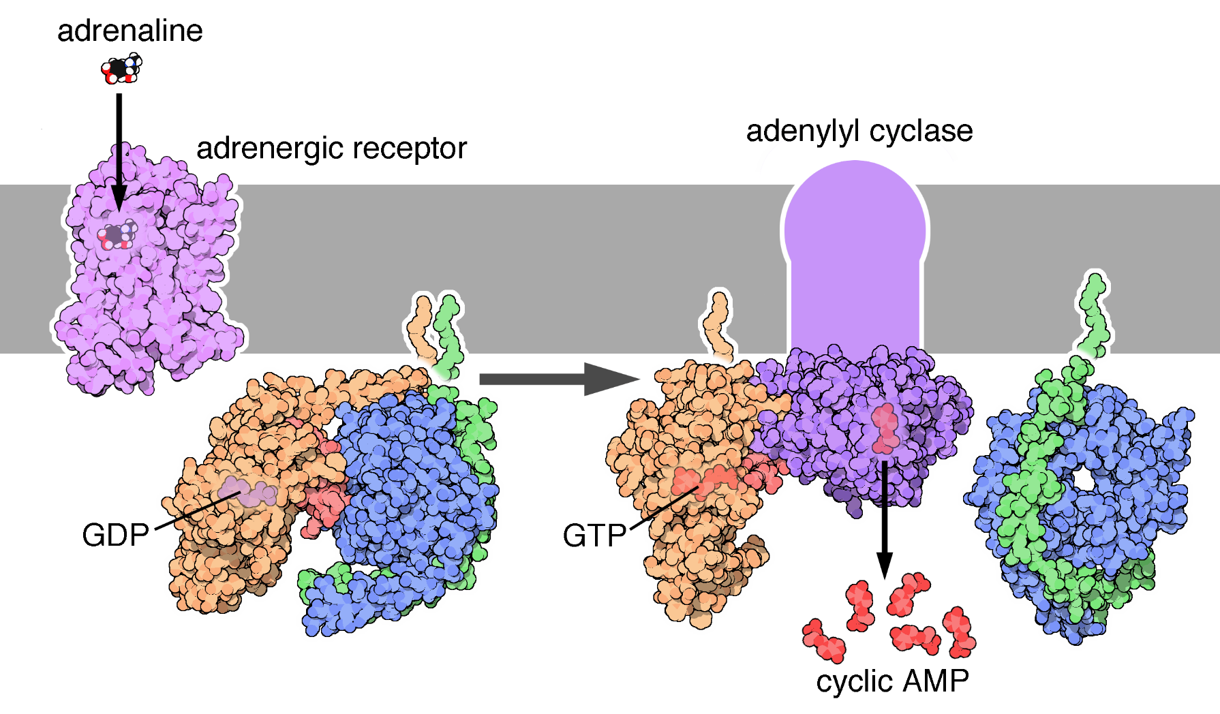
Las proteínas G pueden actuar acopladas a receptores formando un sistema de tres componentes: el receptor, la proteína G a la que se asocia y un sistema efector. Así, cuando el ligando se une a este tipo
de receptores, se produce la activación de la proteína G a la que están asociados, que hidroliza GTP y activa al sistema efector, encargado de generar respuestas muy diversas.
1. PROTEÍNAS G MONOMÉRICAS
Las proteínas G monoméricas son estructuralmente análogas a la subunidad α de las proteínas G heterotriméricas. Pueden estar libres en el citosol, en el nucleoplasma o ancladas a membrana. Algunos ejemplos de ellas son las proteínas
Rho, Rac o Ras.
2. PROTEÍNAS G HETEROTRIMÉRICAS
Las proteínas G heterotriméricas se clasifican atendiendo a la subunidad α que posean: Gs y Gi (que activan e inhiben, respectivamente, la adenilato ciclasa), las Gq (receptor de la fosfolipasa C), las
G12 (tienen que ver con la ruta de la Rho-quinasa), la Gt (transducinas), etc.
El mecanismo general de acción de las proteínas G heterotriméricas sería el siguiente: cuando el GDP está unido a la subunidad α, la proteína se encuentra inactiva (no unida ni al receptor ni al efector). Cuando el
ligando se une al receptor, este último se asocia con la subunidad α, provocando el cambio de GDP por GTP. De esta manera, se activa la proteína y el dímero β-γ se desliga. A continuación, se separa la subunidad α del receptor
y se une al sistema efector (activándolo), que origina segundos mensajeros. Posteriormente se desencadena la respuesta fisiológica. Una vez que ésta tiene lugar, se hidroliza el GTP a GDP y se vuelve a inactivar la proteína G con
la unión del dímero β-γ con la subunidad α. En el esquema que se muestra a continuación, podemos observar el mecanismo explicado:
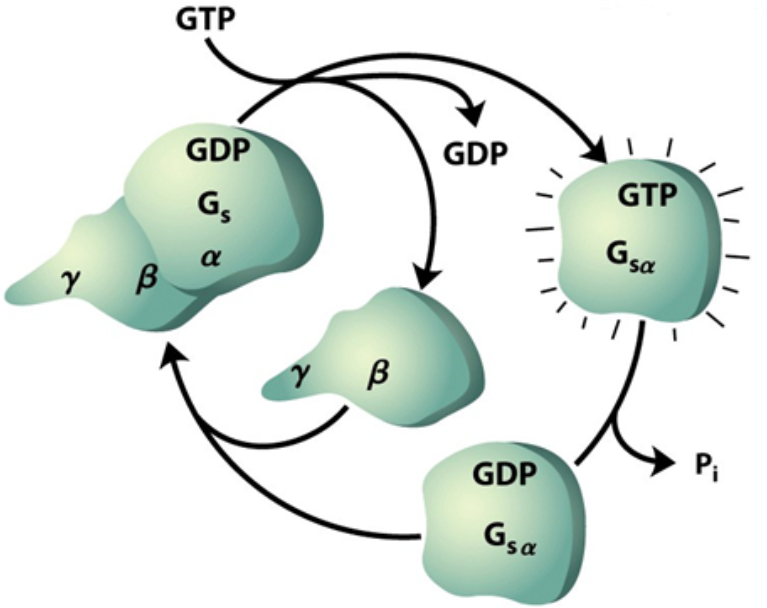
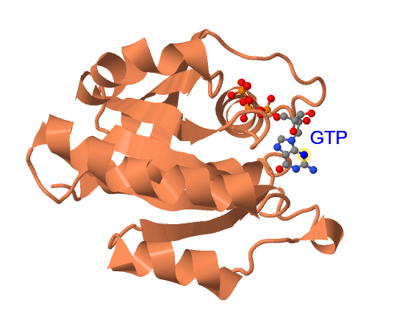
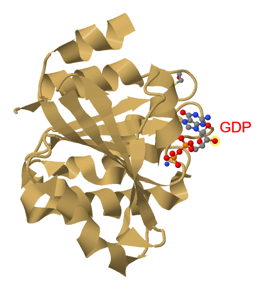
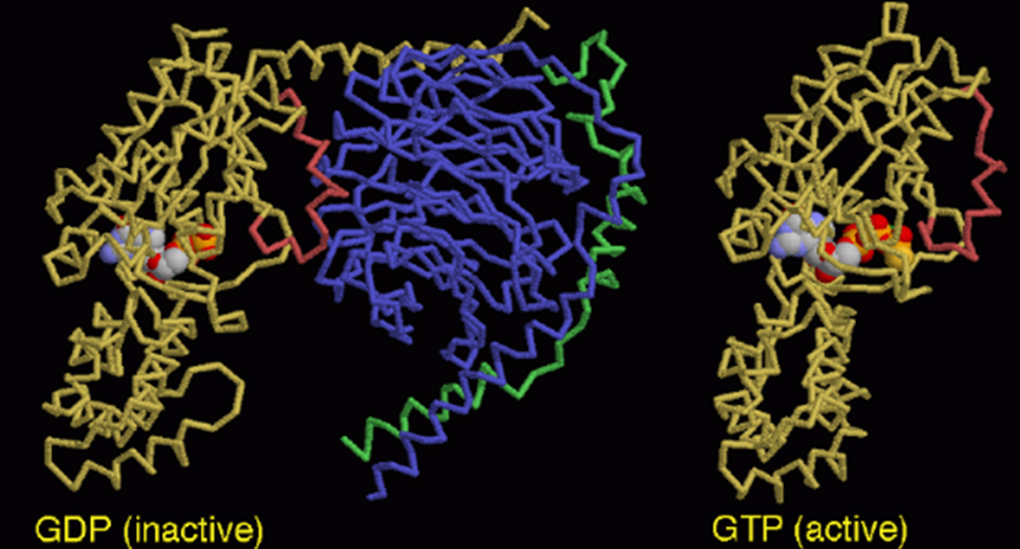
Para complementar la visión de la proteína, en la siguiente imagen, vemos a la izquierda la proteína heterotrimérica unida a GDP y a la derecha a GTP.
2.1. ESTRUCTURA GENERAL PROTEÍNAS G HETEROTRIMÉRICAS
Nos centraremos en las proteínas Gi y Gs.
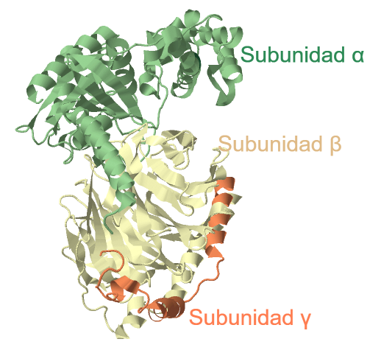
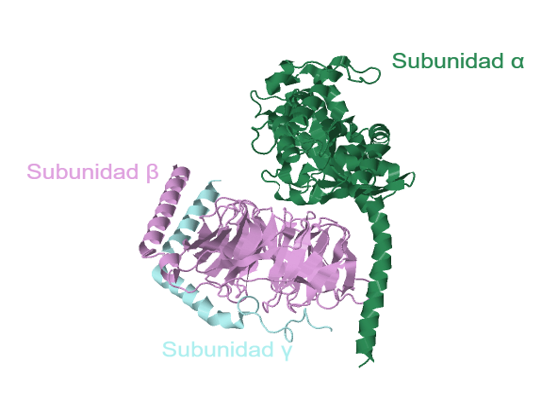
La proteína Gi está compuesta por 3 cadenas correspondientes a las subunidades que conforman la proteína.
• Cadena α (en color verde)
Es un polipéptido de 353 residuos aminoacídicos. En la estructura secundaria abundan las estructuras helicoidales, tanto hélices α como 310, sobre las hebras β. Los residuos restantes corresponden
a estructura secundaria no definida.
• Cadena β (en color amarillo)
Es un polipéptido de 340 residuos aminoacídicos. Al contrario que la cadena α, en la estructura secundaria predominan las hebras β sobre las hélices α.
• Cadena γ (en color naranja)
Es un polipéptido de 71 residuos aminoacídicos. La estructura secundaria está compuesta únicamente por estructuras helicoidales: hélices α y 310.
2.2. DIFERENTES TIPOS DE SUBUNIDAD α
Las diferentes proteínas G heterotriméricas se diferencian en su subunidad α Debido a que parece que proceden todas de un gen común conservado a lo largo de la evolución, la estructura es similar para todas las variantes.
Sin embargo, podemos encontrar algunas diferencias que nos permiten distinguir las diferentes proteínas. Un ejemplo de esto son las deleciones en el extremo N-terminal que presentan las subunidades αi y α0 de
las proteínas Gi, que provoca cambios en la interacción con el dímero βγ.
En la siguiente tabla observamos la clasificación de las proteínas G según su subunidad α:
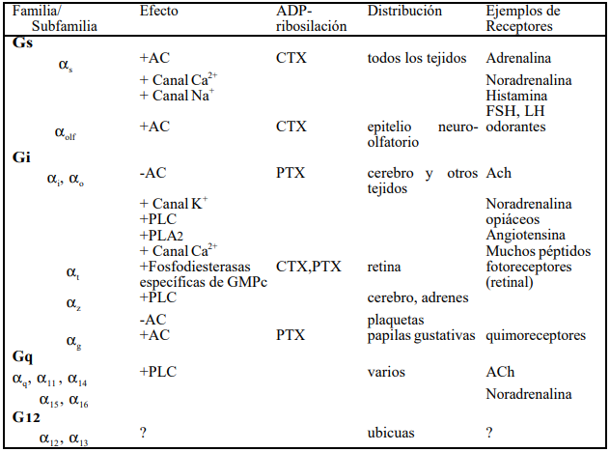
En la tabla también se recogen los diferentes efectos que producen, así como su distribución en los diferentes tejidos y ejemplos de receptores a los que están acopladas.
2.3. DOMINIOS IMPORTANTES DE LA SUBUNIDAD α
La subunidad α de las proteínas G está formada por dos dominios globulares unidos entre sí de tal manera que dejan cierto espacio entre ellos, como se puede observar en la siguiente imagen:
• Dominio helicoidal. En este dominio encontramos una gran α -hélice central rodeada de 5 α-hélices más pequeñas. Algunas de estas hélices más pequeñas son anfipáticas, de manera que orientan sus dominios hidrofóbicos
hacia la región hidrofóbica de la hélice central. Las cadenas laterales forman una red de enlaces débiles uniéndose a través de contactos de van der Walls. Este dominio solo se encuentra en las proteínas G heterotriméricas
y se cree que se encarga de estimular la actividad GTPásica del otro dominio.
• Dominio GTPasa. Se trata de un dominio altamente conservado presente en todos los tipos de proteínas G, ya que su función es unirse al nucleótido e hidrolizar el fosfato terminal. Este dominio cuenta con una hoja-β
central formada por seis láminas-β (B1, B2, B3, B4, B5 y B6) y rodeada por cinco α-hélices (A1, A2, A3, A4 y A5). La estructura está de nuevo mantenida por una de red de fuerzas de van der Walls interna. Las regiones con estructura
secundaria están unidas mediante bucles carentes de estructura secundaria, es precisamente en estos bucles donde se encuentran los aminoácidos más conservados. Existen cinco bucles:
o G1: entre B1 y A1, se encarga
de la unión al nucleótido (fosfato).
o G2: antes de B2, se encarga de la unión al fosfato γ.
o G3: entre B3 y A2, se encarga de la unión al fosfato γ hidrólisis.
o G4: entre B5 y A4, se encarga
de la unión al nucleótido por el anillo de guanina.
o G5: entre B6 y A5, se encarga de la unión al nucleótido por el anillo de guanina.
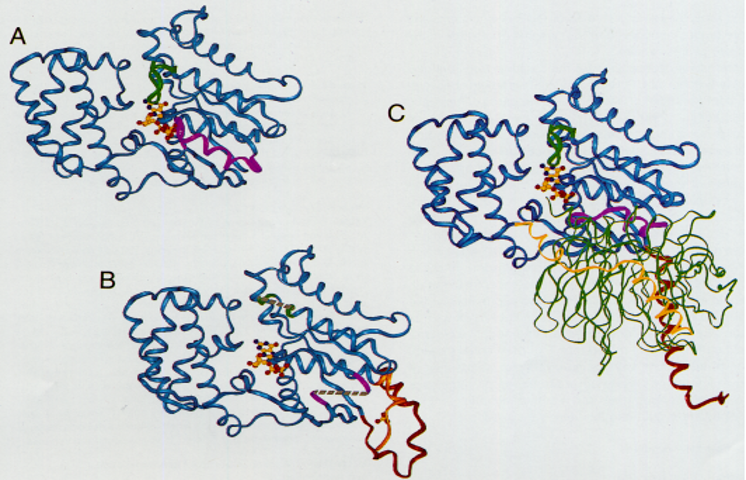
En la siguiente imagen se ilustra el cambio conformacional de la subunidad
α de la Gi cuando está unida al GTP. Vamos a explicar cada figura:
A. La subunidad-α unida a GTP.
B. La subunidad α unida a GDP. Ha sufrido un cambio conformacional de modo que los extremos amino y carboxilo terminal
(rojo y naranja, respectivamente) forman un microdominio compacto.
C. La subunidad-α se une a las subunidades β y γ (verde y amarillo, respectivamente), de tal manera que el extremo amino terminal de la subunidad-α rodea
a la subunidad-β
2.4. REGIONES IMPLICADAS EN EL CAMBIO CONFORMACIONAL
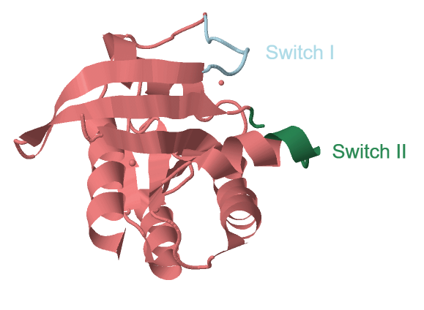
Las
regiones switch son aquellas implicadas en el cambio conformacional ya que poseen aminoácidos que contactan con el fosfato γ del GTP e inducen su hidrólisis a GDP. Podemos encontrar estas regiones tanto en las proteínas
G monoméricas como en la subunidad α de las heterotriméricas. Distinguimos principalmente dos regiones switch implicadas en el proceso. Estas fueron observadas por primera vez en la proteína G monomérica Ras en la que
nos centraremos. Como el dominio GTPasa de la subunidad α está tan conservado entre las proteínas G heterotriméricas y es análogo a las monoméricas, el cambio conformacional es similar en todos los tipos de proteínas G.
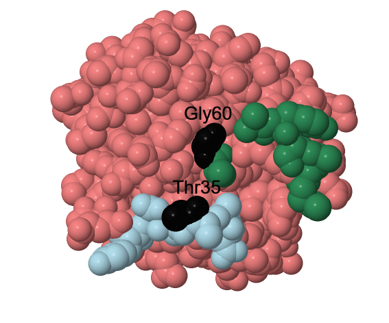
El proceso es el siguiente: cuando la subunidad α está unida a GTP se forman dos puentes de hidrógeno. El grupo amino de los aminoácidos treonina 35 y glicina 60, de las regiones switch I y II, respectivamente, forma el puente
de hidrógeno con el oxígeno del fosfato γ del GTP como podemos ver en la siguiente imagen:
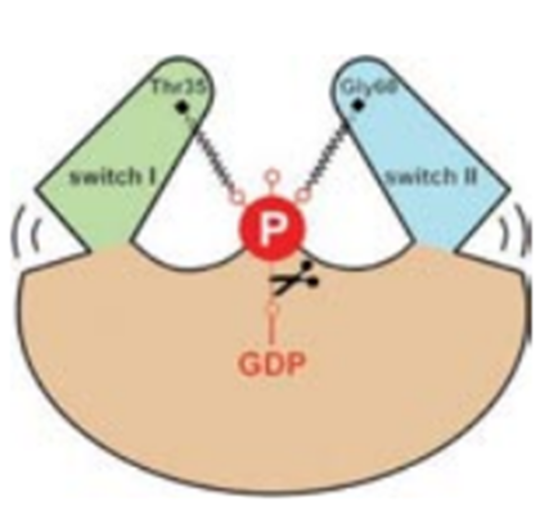
Con la formación de los enlaces, se induce la hidrólisis del GTP, y esto permite que las regiones switch se relajen adoptando la conformación que permite la unión de GDP.
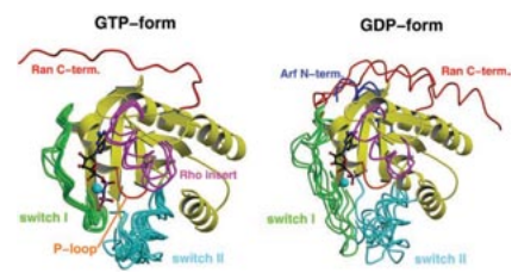
En Ras, la región switch I está delimitada por los residuos 32 y 38, y la región switch II por los residuos 59 y 67 como se muestra a continuación:
3. PROTEÍNAS G Y EL CÁNCER
Como ya hemos visto, las proteínas G presentan un papel en la comunicación celular. Las células se comunican a través de mensajeros moleculares, sin embargo, estos mensajeros en raras ocasiones entran al interior de las células. Lo que ocurre es que las
proteínas G acopladas a receptores en la superficie celular son las que transmiten las señales al espacio intracelular.
Teniendo en cuenta la importante función que desempeñan las proteínas
G, no es de extrañar que su alteración dé lugar a diferentes patologías. Nos centraremos en el cáncer.
Como todos sabemos, el cáncer engloba un conjunto de enfermedades producidas como consecuencia de la proliferación descontrolada
de las células debida a diversas alteraciones, pudiendo llegar a diseminarse por todo el organismo, y darse así la metástasis. Y su sello distintivo es la falta de comunicación.
Nuestras células se mantienen en comunicación
constantemente, no obstante, cuando aparecen las células cancerosas esta comunicación se pierde, y esto las lleva a crecer sin límites. Son muchas las moléculas que sufren cambios cuando una célula se convierte en cancerosa,
como es el caso de los receptores acoplados a proteínas G.
En un estudio realizado con el genoma de diversas células cancerosas se observó que son muy frecuentes las alteraciones en el sistema de señalización de las proteínas
G. Cerca de 800 receptores diferentes de este tipo son codificados por nuestro genoma, y las mutaciones que sufren aparecen en un quinto de todos los tipos de cáncer. También es muy común encontrar mutaciones en las proteínas
G. Además, es importante que los receptores no se expresen en un lugar erróneo, ya que esto puede derivar en el desarrollo del cáncer ayudando a que estas células se muevan y se produzca la metástasis.
La señalización
a través de los receptores acoplados a proteínas G se produce a través de pequeños cambios en sus hélices. Las mutaciones más comunes se producen en las interfaces entre las hélices.
Para profundizar en el conocimiento
de cómo están implicadas las subunidades α de las proteínas G heterotriméricas de tipo s (estimuladora de la actividad adenilil ciclasa) y tipo i (inhibidora de la actividad adenilil ciclasa) en el cáncer de próstata humano,
se llevó a cabo un estudio con el tejido prostático de diferentes pacientes. Al aparecer mutaciones específicas en los genes que codifican las proteínas, estos pueden convertirse en oncogenes cuyos productos activen el desarrollo
de las células cancerosas. Así, se ha demostrado la presencia de mutaciones en las subunidades α de las proteínas Gi y Gs.
4. ALTERACIÓN DE LAS PROTEÍNAS G: LAS TOXINAS
Las proteínas G son las dianas de muchas toxinas secretadas por bacterias parasitarias, como Vibrio Cholerae, causante de la cólera, o Bordetella pertussis, causante de la tos ferina:
• El colerágeno, la toxina
secretada por Vibrio Cholerae, es una proteína que consta de dos subunidades. La subunidad B permite el anclaje al epitelio intestinal al unirse a unos residuos azucarados; mientras que la subunidad A se introduce en las células,
donde provoca la disfunción de las proteínas G. En concreto, esta toxina provoca la activación permanente de la proteína G, que, a su vez, activa de manera constitutiva la proteína quinasa A, como consecuencia se produce la
pérdida de NaCl y de agua en el intestino. La subunidad A del colerágeno provoca la unión de una ADP-ribosa a la subunidad G-α, lo que estabiliza la forma unida a GTP.
• Por su parte, la toxina pertúsica, causante
de la tos ferina, también une una ADP-ribosa la subunidad G-α, pero en este caso disminuye su afinidad por GTP, es decir, se produce la inactivación constitutiva.
5. Autores
Guion elaborado por Andrea Desirée Pérez Maldonado, Carla Sánchez Comerón, Estefanía Sánchez Díaz y Mª del Carmen Vicente de la Peña, alumnas de Química e Ingeniería de Proteínas, 3er curso del Grado en Biotecnología, curso 2019/20.
6. Bibliografía
Mark A. Wall, David E. Coleman, Ethan Lee, Jorge A. IAiguez-Lluhi, Bruce A. Posner Alfred G. Gilman and Stephen Ft. Sprang. (1995). The Structure of the G Protein Heterotrimer Giα1β1γ2. Cell, 83, 1047-1058.
Xiangyu Lu, Xinyu Xu and Daniel Hilger. (2019). Structural Insights into the Process of GPCR-G Protein Complex Formation. Cell Press, 177, 1243-1251.
Miriam Hirshberg, Richard W. Stockley, Guy Dodson & Martin R. Webb. (1997). The crystal structure of human rac1, a member of the rho-family complexed with a GTP analogue. Nature Structural Biology, 4, 147–152
Ingrid R. Vetter and Alfred Wittinghofer. (2001). The Guanine Nucleotide–Binding Switch in Three Dimensions. Science, 294, 1299-1304.
PDB 101. (2013). G Proteins and Cancer. Sitio web: https://pdb101.rcsb.org/learn/structural-biology-highlights/g-proteins-and-cancer
Omar Jesús Santana García. (2018). Bases estructurales de los receptores acoplados a proteínas G. pág 5. Trabajo de fin de grado. Universidad de La Laguna.
Tema 1. Mecanismos de Transducción de señales por receptores de membrana. Sitio web: http://webs.ucm.es/info/biomol2/Tema%2001.pdf