La síntesis de timidilato
La dihidrofolato reductasa es una enzima que juega un papel esencial en la replicación del DNA participando en la síntesis de timidilato o ácido desoxitimidílico, dTMP. Químicamente, la timina es 5-metil-uracilo por lo que dTMP será biosintetizado a partir
de dUMP.
La reacción de síntesis de dTMP consiste en la metilación del resto de uracilo y es catalizada por la timidilato sintasa, enzima que usa N5,N10-Metilén-Tetrahidrofolato
como donador del resto monocarbonado necesario.

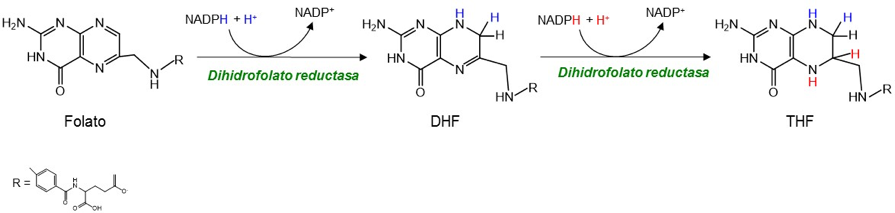
Además de donar el grupo metileno, el N5,N10-Metilén-Tetrahidrofolato actúa como agente reductor, aportando también un ión hidruro, que junto con el grupo metileno se convierten en el metilo del C5 de la base nitrogenada. En definitiva, el anillo pteridina del tetrahidrofolato (THF) pierde dos átomos de H y se oxida a dihidrofolato (DHF). Para recuperar los niveles de N5,N10-Metilén-THF, el DHF se reduce por acción de la dihidrofolato reductasa (DHFR) y se metila por la enzima serina hidroximetil transferasa (SHMT). Las concentraciones celulares de los derivados del ácido fólico son normalmente bajas, por lo que es preciso que se regeneren continuamente, de ahí la importancia de ambas enzimas.
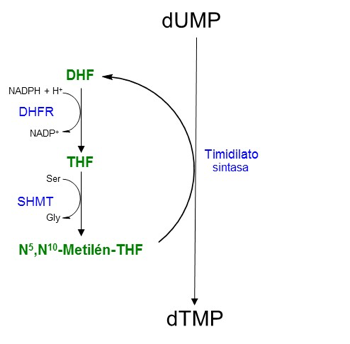
Además, la DHFR interviene en la síntesis de THF a partir del ácido fólico (la vitamina B9 de la dieta) mediante dos reacciones sucesivas dependientes de NADPH: la reducción del ácido fólico a DHF, y la reducción de DHF a THF. Esta segunda reacción es más significativa, siendo el DHF el sustrato preferido de la enzima debido a la necesidad de una regeneración constante del THF a partir del DHF, producido éste en la reacción de la timidilato sintasa.
La DHFR
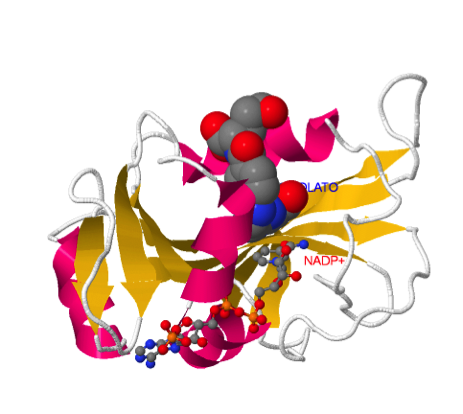
En la mayoría de los organismos, la DHFR es una enzima monomérica constituida por una cadena polipeptídica de unos 160 (DHFR de bacterias) o 186 aminoácidos (DHFR de mamíferos). En plantas y algunos protozoos, las actividades DHFR y timidilato sintasa se localizan en la misma cadena polipeptídica, resultando en una enzima bifuncional que canaliza el DHF desde el sitio activo de la timidilato sintasa al sitio de la DHFR.
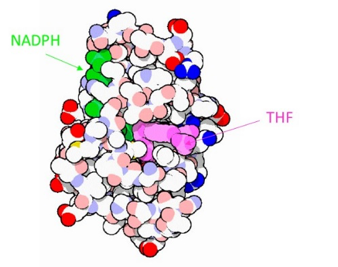
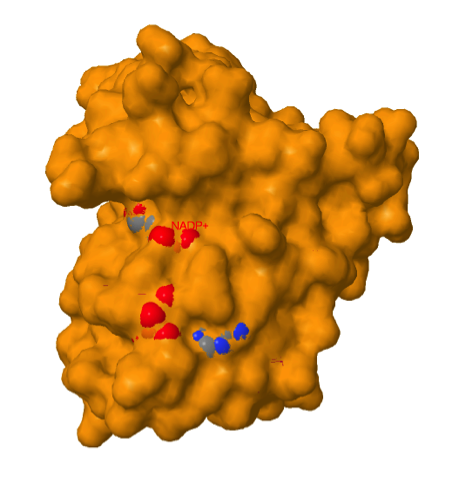
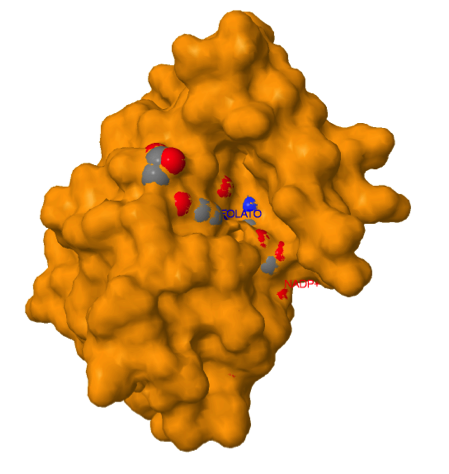
El cofactor NADPH se une a la enzima en un “bolsillo” complementario en forma y en propiedades iónicas.
El folato se une de forma doblada en lugar de forma lineal.
El anillo de piridina del NADPH está muy cerca del anillo de pteridina del ligando folato, para permitir la transferencia del hidruro entre ambos anillos que cataliza la enzima.
La DHFR, diana de agentes anticancerígenos, antibacterianos y antiparasitarios.
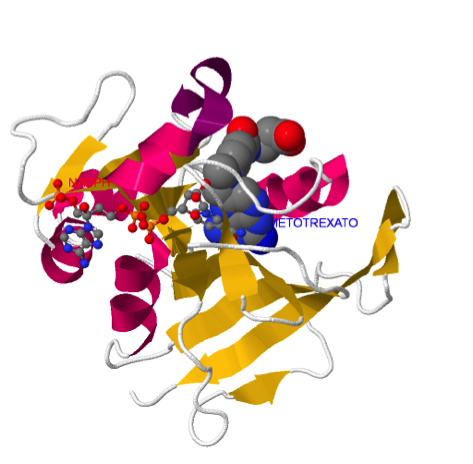
Teniendo en cuenta la necesidad de regeneración del cofactor THF, se comprende fácilmente la acción de determinados fármacos anticancerígenos y antimicrobianos que bloquean la síntesis de timidilato. Las células que se dividen rápidamente como células cancerígenas, bacterias y protozoos, necesitan abundante aporte de timidilato para la síntesis de DNA. En quimioterapia anticancerígena se usan fármacos que tienen como diana la timidilato sintasa y la dihidrofolato reductasa para bloquear la síntesis de nucleótidos y, por ende, la división celular. Los fármacos metotrexato (o ametopterina) y aminopterina son análogos del ácido fólico.
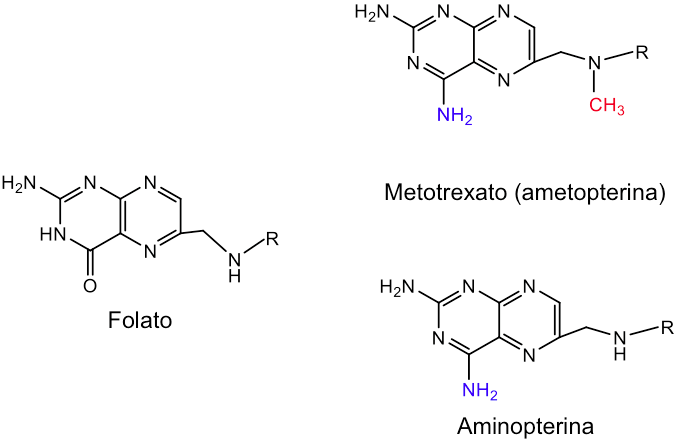
Estos fármacos inhiben la dihidrofolato reductasa mediante un mecanismo de inhibición reversible y de tipo competitivo. La afinidad de la dihidrofolato reductasa por estos fármacos es 1000 veces superior a la del dihidrofolato.
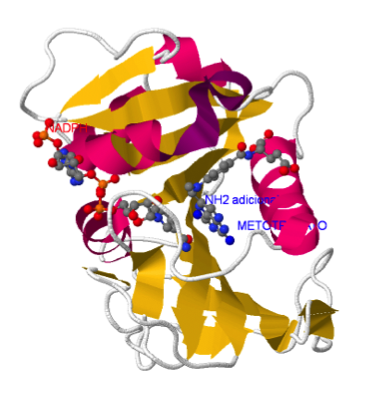
El grupo –NH2 adicional del metotrexato permite la formación de un puente de H adicional con la enzima que aumenta la afinidad de unión de este análogo del sustrato.
El metotrexato se usa para el tratamiento de cánceres de crecimiento rápido como son leucemia en niños y coriocarcinoma (cáncer de células de la placenta). Las dosis suministradas no pueden ser muy altas puesto
que las células normales también quedan afectadas: se inhibe el crecimiento no sólo de las células cancerígenas sino también de los folículos pilosos, células madre de la médula ósea, células epiteliales del tubo digestivo, provocando
efectos secundarios como caída de pelo, debilitamiento del sistema inmunitario, vómitos, etc.
La estrategia de aplicación consiste en administrar una dosis letal de metotrexato, y algunas horas después se “rescata” al paciente
(pero no al cáncer) administrando dosis altas de 5-formil-THF y/o timidina.
Cuestiones
Responder al cuestionario correspondiente en la página de Studium
Referencias
Goodsell D., RCSB PDB Molecule of the Month doi: 0.2210/rcsb_pdb/mom_2002_10
Mathews, C. K.; van Holde, K. E. & Appling D.R. (2013) Bioquímica, 4ª ed.. Pearson Educación, Madrid.
PDB www.rcsb.org, H.M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) The Protein Data Bank URL: Nucleic Acids Research, 28: 235-242.
Voet, D.; Voet, J.G. & Pratt, C.W. (2008) Principles of Biochemistry, 3th Edition. Editorial Wiley