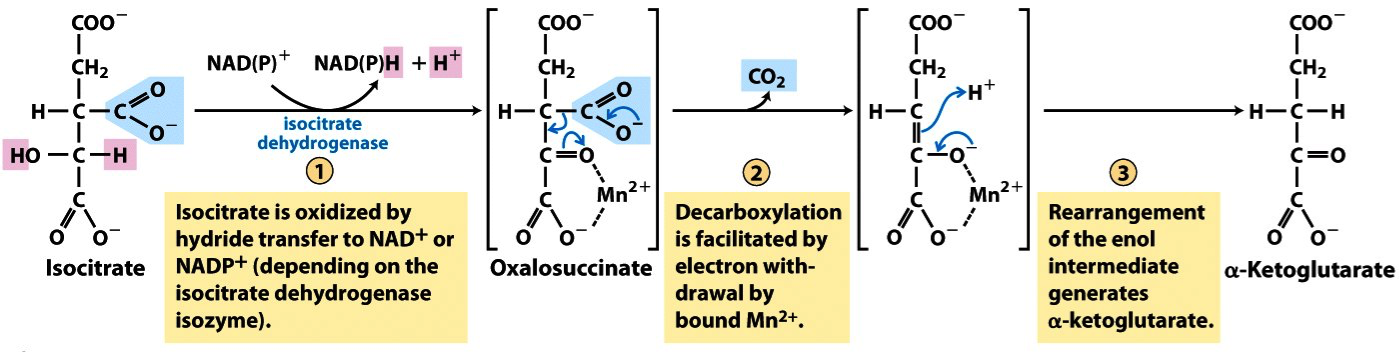
La isocitrato deshidrogenasa (IDH) cataliza la conversión de isocitrato en α-cetoglutarato (α-KG) con la consiguiente producción de CO2 y NAD(P)H. Existe un isozima citosólico/peroxisómica (IDH1) y dos mitocondriales (IDH2 e IDH3). IDH1 e IDH2 son dependientes de NADP+, y por lo tanto aportan a la célula poder reductor en forma de NADPH. El isozima IDH3, dependiente de NAD+, cataliza uno de los pasos del ciclo de Krebs, y es lógicamente necesaria para la respiración celular
Estructura de la IDH1
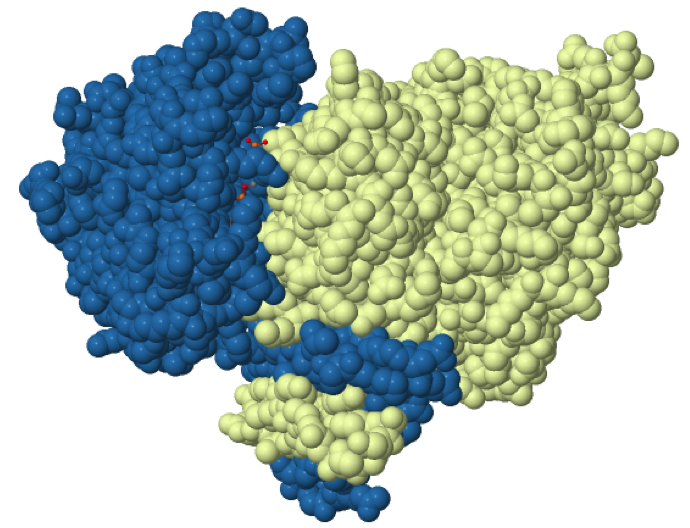
Estructuralmente la IDH1 se clasifica como una proteína α/β, que puede formar un dímero de 2 subunidades iguales o un tetrámero formado por 2 dímeros. El tetrámero parece ser la forma funcional de la proteína.
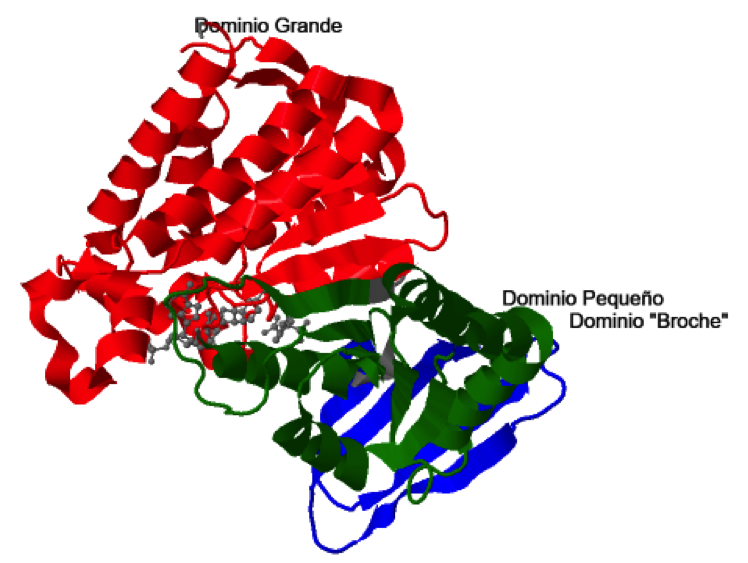
En cada una de las subunidades se pueden diferenciar tres dominios: dominio grande, dominio pequeño y dominio “broche”. La dimerización y tetramerización está mediada por interacciones a nivel de los dominios “broche” y de los dominios pequeños.
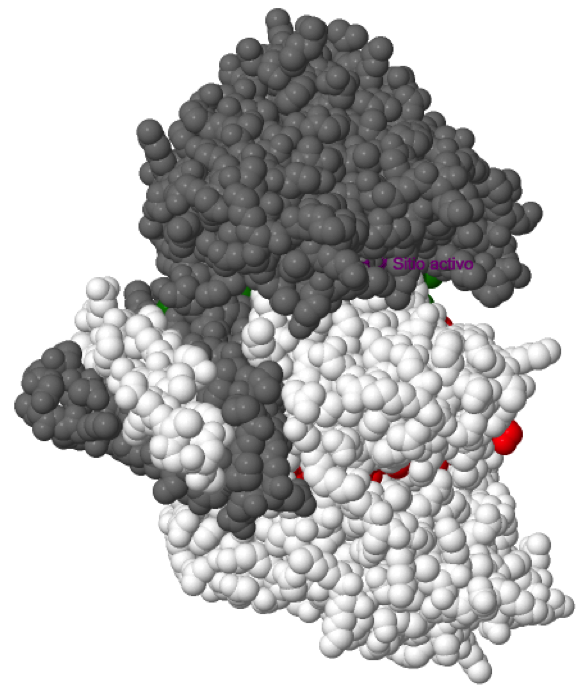
Sitio activo
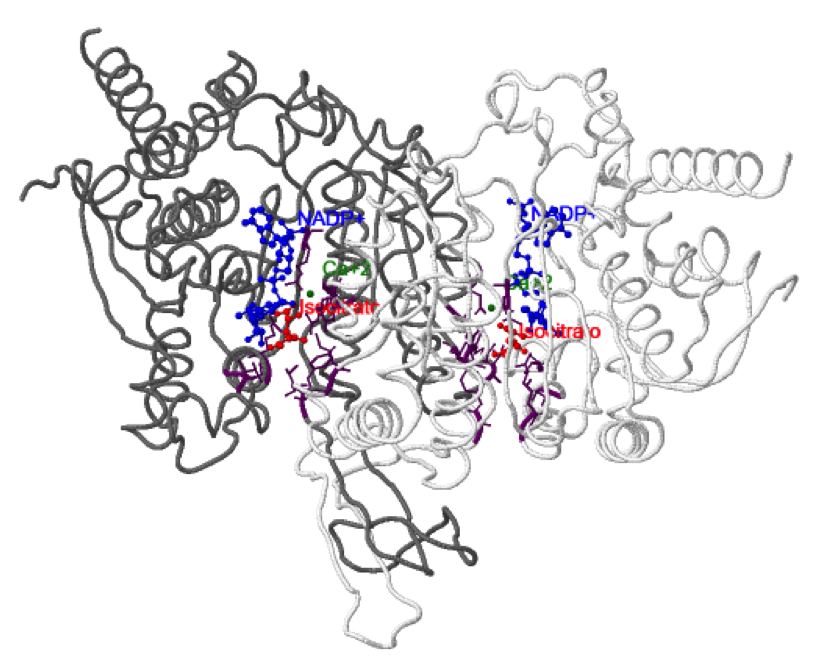
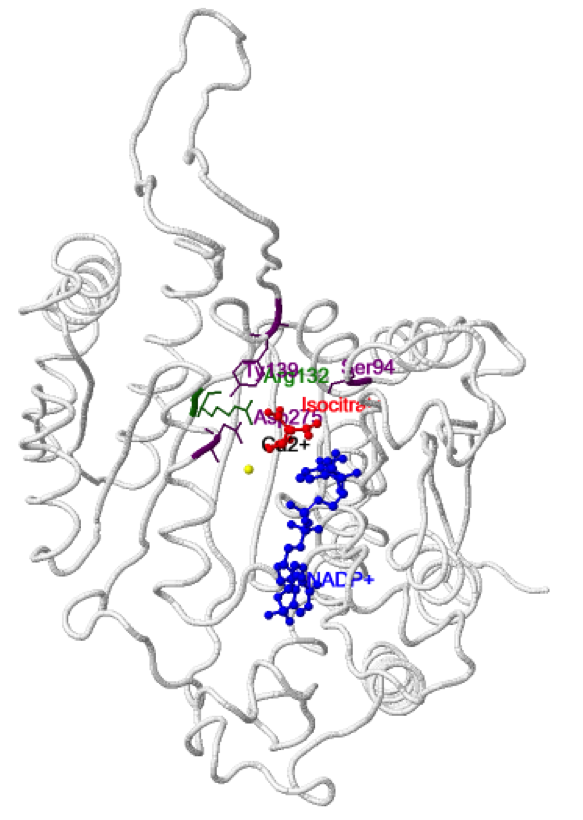
Los dominios grande y pequeño se unen entre sí por una lámina β ( en rojo y verde) y ambos lados de esta lámina se pueden distinguir dos surcos de naturaleza hidrofílica. En uno de estos surcos se sitúa el sitio activo, concretamente en el formado por los dominios grande y pequeño de una subunidad y por el dominio pequeño de la subunidad adyacente, de forma que hay 2 sitios activos por cada dímero proteico. Se puede observar el isocitrato y el NADP+ en color púrpura.
El isocitrato interacciona con: Thr77, Ser94, Arg100, Arg109, Arg132, Tyr139 y Asp275 de una subunidad; Lys212, Thr214, y Asp252 de la subunidad adyacente, representados en púrpura en la estructura. Todos estos residuos están conservados en todas las IDHs eucarióticas dependientes de NADP+. El isocitrato contacta también con 3 moléculas de agua, con el NADP+ y con el catión divalente (Mn2+, Mg2+ o Ca2+). Los residuos implicados en la quelación del catión divalente (Asp275, Asp279 y Asp252) también están altamente conservados. El NADP+ establece interacciones principalmente con residuos del dominio grande.
Diferencias conformacionales
El complejo enzimático puede presentar distintas conformaciones que afectan a la estructura local del sitio activo:
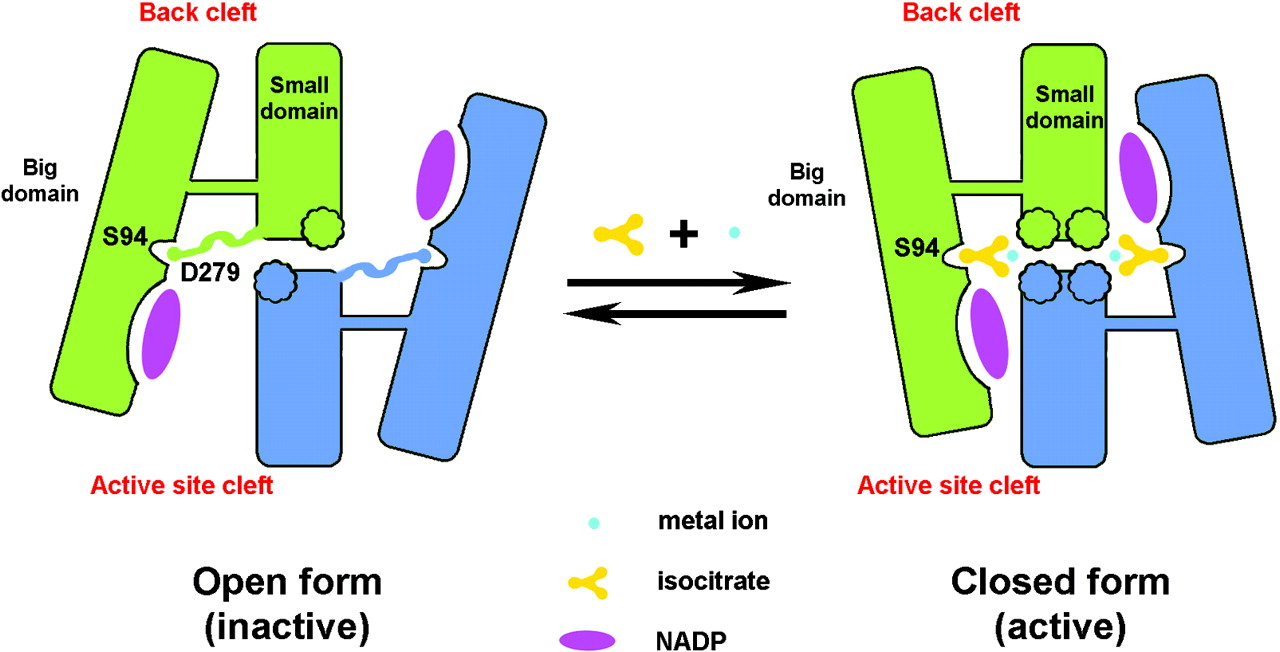
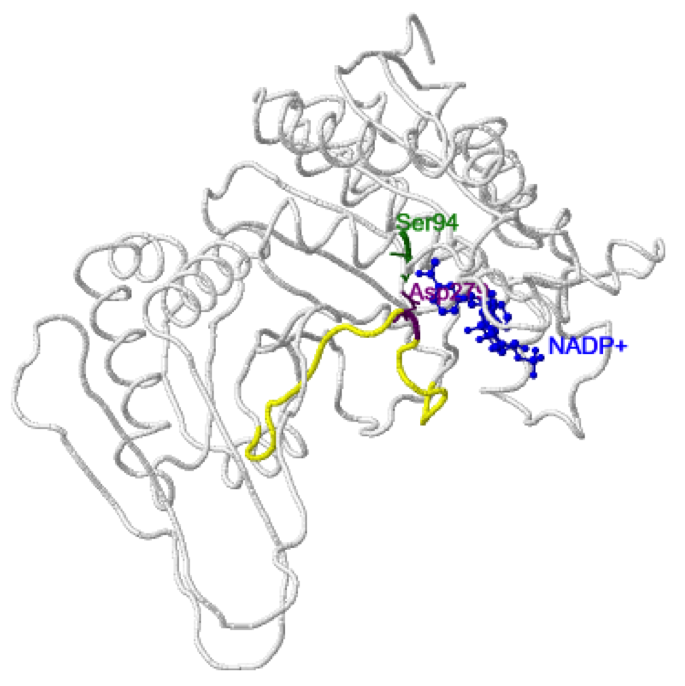
Conformación abierta (inactiva): en ausencia de isocitrato el surco del sitio activo está abierto y el surco posterior cerrado. Esta conformación está estabilizada entre otras cosas por un contacto entre el
Asp279 del dominio pequeño con la
Ser94 del dominio grande. Este contacto impediría la unión del
isocitrato, ya que el
Asp279 ocupa la posición exacta donde se situará el
isocitrato. Además, es interesante señalar que en esta conformación la región donde se halla el
Asp279 presenta una estructura extendida (en amarillo en la estructura).
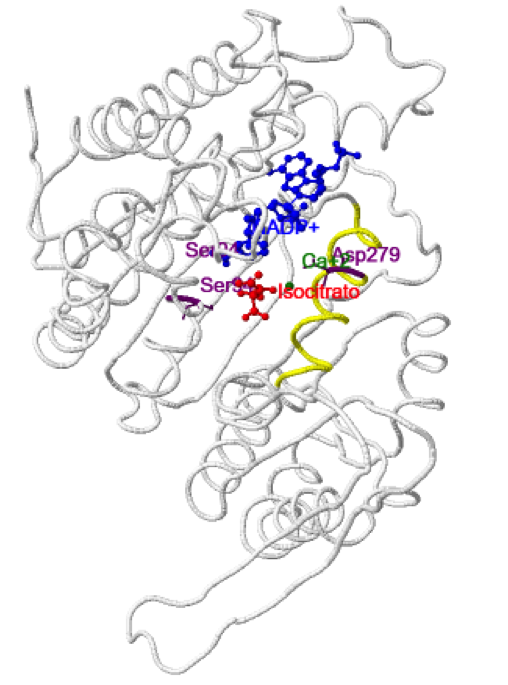
Conformación cerrada (activa): Cuando la concentración de isocitrato (y del catión divalente) alcanza cierto nivel se une al sitio activo, rompiendo los puentes de hidrógeno de la interacción Asp279- Ser94, provocando la expulsión del Asp279 del sitio activo e interaccionaría con el Ca2+. Además, la región donde se halla el Asp279 que en la conformación inactiva presentaba una estructura extendida, ahora adopta estructura en hélice α (en amarillo en la estructura), lo que permite la entrada del isocitrato. De este modo el sitio activo se cierra y el surco posterior se abre. El cambio conformacional entre la forma abierta y cerrada se produce por un movimiento de bisagra a nivel de la lámina β situada entre el dominio “broche” y el dominio pequeño.
IDHs y cáncer
En algunos tipos de tumores, como los gliomas de grado II-III o la leucemia mieloide aguda (LMA), son frecuentes la aparición de mutaciones somáticas puntuales recurrentes en algunos residuos de IDH1 (Arg132) e IDH2 (Arg172, Arg140). Sorprendentemente dichos mutantes se consideran mutantes de “ganancia de función” que catalizan la conversión de α-KG en D-2-hidroxiglutarato (2-HG). Las proteínas mutante y silvestre de IDH1 forman heterodímeros, de forma que el α-KG citosólico se metaboliza a 2-HG. El 2-HG incrementa la proliferación tumoral y la metástasis a través de diferentes mecanismos que implican entre otras cosas, incremento del estrés oxidativo, metilación del DNA, la activación de ciertas vías de señalización, estabilización de HIF1α o incremento de la angiogénesis.
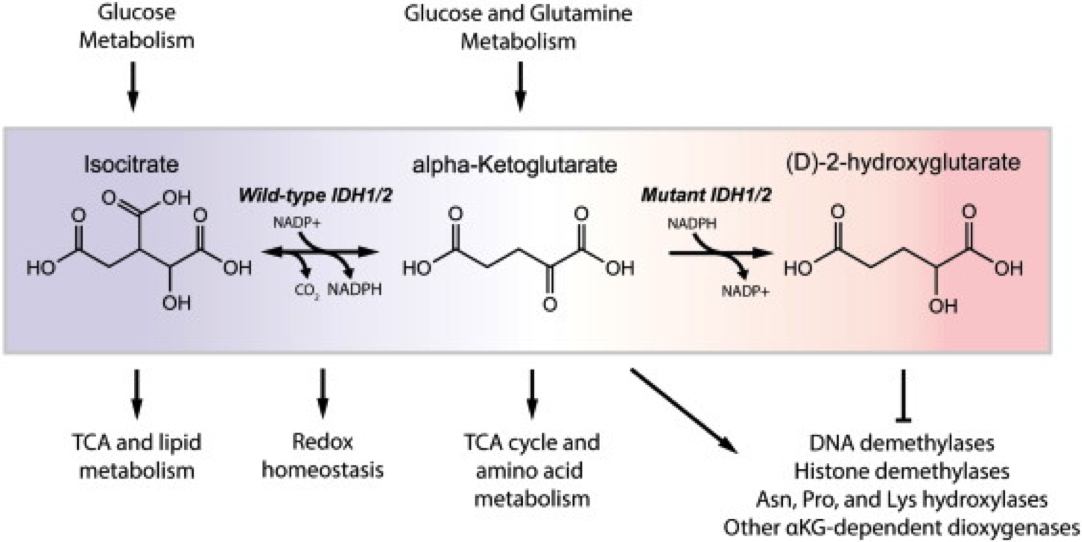
Mutación de la Arg132 de las IDHs
Una de los residuos más frecuentemente afectado por las mutaciones en IDH1 e IDH2 es la
Arg132, que puede sufrir cambios a distintos aminoácidos, el más frecuente a His (R132H). La
Arg132 es uno de los residuos que se unen directamente al
isocitrato. La mutación de la
Arg132 impide la unión del
isocitrato, y los enzimas mutantes son insensibles a las concentraciones fisiológicas de
isocitrato.
A continuación se puede observar la estructura de la IDH1 silvestre unida a
isocitrato,
NADP+ y Ca2+.
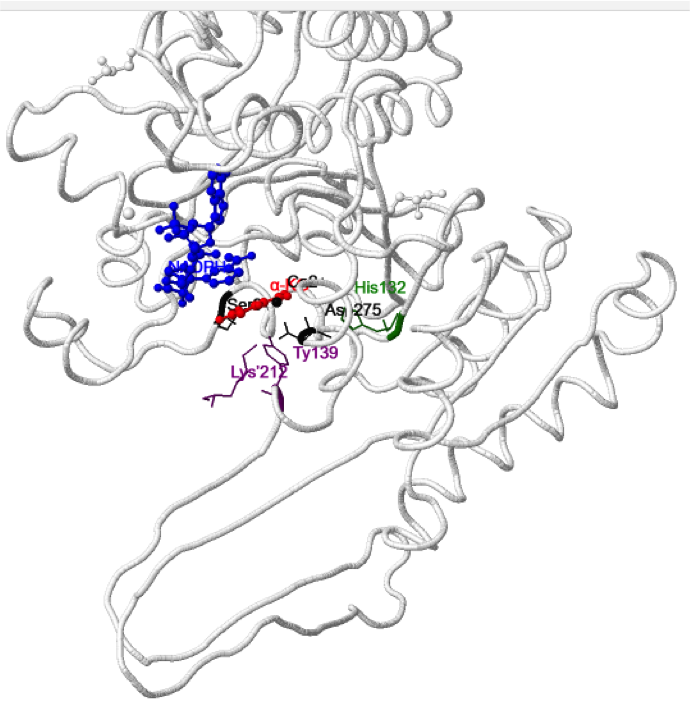
En la siguiente figura se puede observar la estructura del mutante R132H unido a α-KG, NADPH y Ca2+.
La mutación R132H afecta al equilibrio conformacional, favoreciendo la estabilización de la conformación cerrada del enzima. En segundo lugar, la pérdida del grupo guanidinio de la Arg132 (en verde en la estructura de la proteína silvestre) hace que desaparezcan numerosas interacciones del isocitrato con el sitio activo, y además se observa una reorganización del sitio activo en el mutante, como el cambio de posición de los residuos Tyr139 o Lys’212, ambos importantes para el mecanismo de acción de la proteína silvestre. En su conjunto, una simple mutación puntual, como por ejemplo R132H, promueve la formación de un sitio activo distinto al de la proteína silvestre. En el mutante la afinidad por el NADPH se incrementa, la posición del α-KG es distinta a la que adopta el isocitrato en la proteína silvestre, lo que en definitiva desemboca en la captación de NADPH y reducción del α-KG a 2-HG.
A la vista de la importancia de las mutaciones de IDH1 e IDH2 para el desarrollo de gliomas o leucemias, se han comenzado a desarrollar inhibidores específicos frente a los mutantes, algunos de los cuales están actualmente en fase de ensayo clínico para probar su aplicabilidad en humanos.
http://www.jbc.org/content/290/2/762.long
http://pubs.acs.org/doi/10.1021/jm500660f
Cuestiones
Responder al cuestionario correspondiente en la página de Studium
Referencias
PDB www.rcsb.org, H.M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) The Protein Data Bank URL: Nucleic Acids Research,
28: 235-242.
Lehninger Principles of Biochemistry 6th Ed. ISBN-10: 1-4292-3414-8; ISBN-13: 978-1-4292-3414-6
Xiang Xu et al. (2004). Metabolic consequences of oncogenic IDH mutations. J. Biol. Chem. 2004;279:33946-33957. http://www.jbc.org/content/279/32/33946.long
Parker, S.J. & Metallo, C.M. (2009). Metabolic consequences of oncogenic IDH mutations. Pharmacology & Therapeutics, Volume 152, 2015, 54–62. http://dx.doi.org/10.1016/j.pharmthera.2015.05.003
Dang, L. et al. (2009). Cancer-associated IDH1 mutations produce 2-hydroxyglutarate. Nature. 462, 739-744. http://www.nature.com/nature/journal/v465/n7300/full/nature09132.html