Introducción
Los ácidos grasos desempeñan funciones clave en los sistemas biológicos: reserva energética, componentes de las membranas biológicas, moléculas de señalización celular, etc. Aunque la dieta aporta la mayoría de los ácidos grasos necesarios,
muchos tejidos como el hígado y el tejido adiposo son capaces de sintetizarlos. En todos los sistemas biológicos, la síntesis de ácidos grasos sigue la misma ruta metabólica, aunque pueden diferir las enzimas implicadas. La biosíntesis
de ácidos grasos ocurre en el citosol, a partir de Acetil-Coenzima A (Acetil–CoA), que a su vez es un producto de la degradación de ácidos grasos.
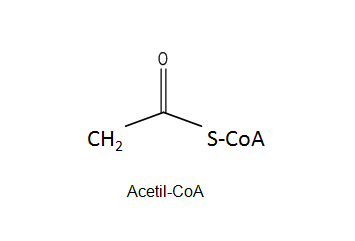
La síntesis de ácidos grasos consiste en enlazar dos átomos de carbono entre sí y reducirlos para formar un ácido graso. Mayoritariamente se sintetiza un ácido graso saturado de 16 átomos de carbono, el ácido palmítico o palmitato.
El palmitato servirá de precursor de otros ácidos grasos.
En las células eucariotas, la síntesis de ácidos grasos se lleva a cabo en tres etapas:
1. Salida del Acetil-CoA desde la mitocondria al citosol.
2. Activación del Acetil-CoA a Malonil-CoA.
3. Síntesis de los ácidos grasos propiamente dicha.
En la Etapa 2, la carboxilación de Acetil-CoA dará como producto Malonil-CoA mediante la reacción catalizada por la enzima Acetil-CoA carboxilasa, que es el
paso limitante en la biosíntesis de ácidos grasos.
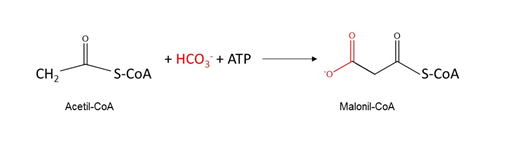 Reacción de la Acetil-CoA carboxilasa
Reacción de la Acetil-CoA carboxilasa
La ácido graso sintasa
La biosíntesis de ácidos grasos consiste en la sucesiva condensación y reducción de dos átomos de carbono que se añaden a una cadena de ácido graso (acilo) en elongación. El Malonil-CoA es el donador de todos los carbonos del
ácido palmítico excepto de dos, que provienen directamente de una molécula de Acetil-CoA.
La condensación de dos átomos de C implica siete actividades enzimáticas y la intervención de una proteína transportadora de acilos, actividades asociadas a la ácido grasosintasa (AGS):
- Actividades Malonil/Acetil
Transacilasa (MAT)
- Actividad β-Cetoacil-Sintasa (KS)
- Actividad β-Hidroxiacil-Deshidratasa (DH)
- Actividad Enoil-Reductasa (ER)
- Actividad β-Cetoacil-Reductasa (KR)
- Actividad Tioesterasa (TE)
- “Acil carrier protein” (ACP), proteína portadora de acilos.
En bacterias y plantas, la AGS es un complejo supramolecular formado por siete polipéptidos distintos; la AGS de levaduras y hongos está formada
dos cadenas polipeptídicas diferentes, α y β, organizadas en una estructura supra molecular de 2600 kDa constituida por seis cadenas α y seis cadenas β. Las seis subunidades α (con actividades KS, KR y ACP)
forman una
rueda central (en tonos marrones en la imagen mostrada más abajo); a ambos lados de la rueda se encuentran sendas
cúpulas (en tonos azules) formadas por trímeros de las subunidades β que contiene los sitios activos de ER, DH y MAT. En el agujero central del complejo ocurre la síntesis del ácido graso.
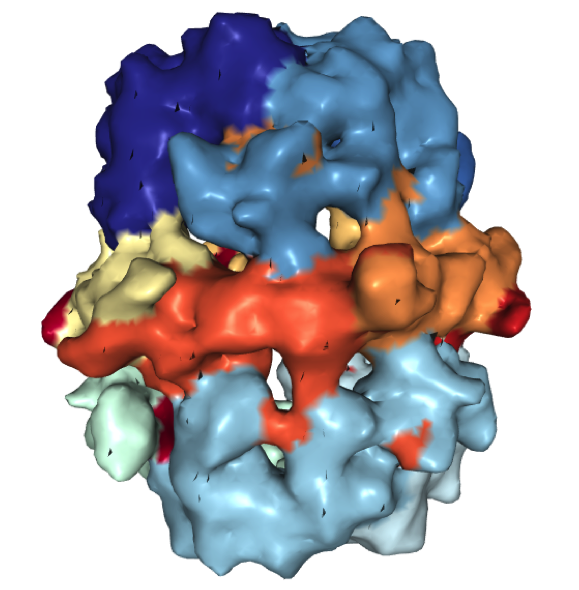
AGS de levaduras y hongos
En la AGS de animales, las siete actividades enzimáticas y la ACP están localizadas en una única cadena polipéptídica de 273 kDa que se pliega en nueve dominios diferentes, ordenados según se esquematiza:
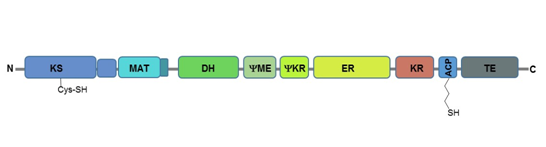 Dominios de la AGS de mamíferos
Dominios de la AGS de mamíferos
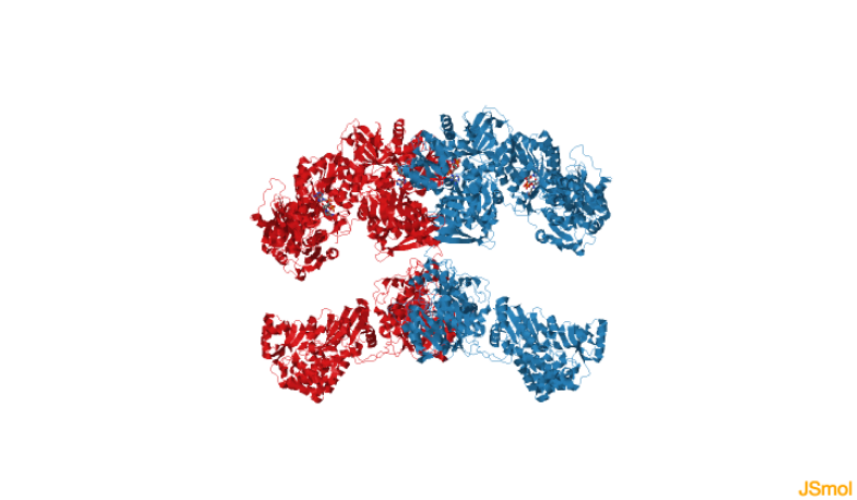
La AGS de mamíferos es un homodímero de 540 kDa constituido por dos cadenas polipeptídicas idénticas de 2512 aminoácidos y 273 kDa mostradas en el siguiente modelo en
azul y
rojo. Las dos subunidades de la AGS tienen una forma aproximada de C, y se entrelazan formando una X asimétrica. Ambas pueden sintetizar simultáneamente un ácido graso.
AGS de mamíferos
En la estructura de rayos X de la proteína, se observan cinco dominios donde se localizan los sitios activos de las actividades enzimáticas KS, MAT, DH, ER y KR, así como dos dominios no enzimáticos denominados pseudometiltransferasa
(
ψME) y pseudocetoreductasa (ψKR). En el cristal no se visualiza el extremo C terminal correspondiente a la ACP y al dominio TE. El posible lugar de anclaje de la ACP se indica con un asterisco.
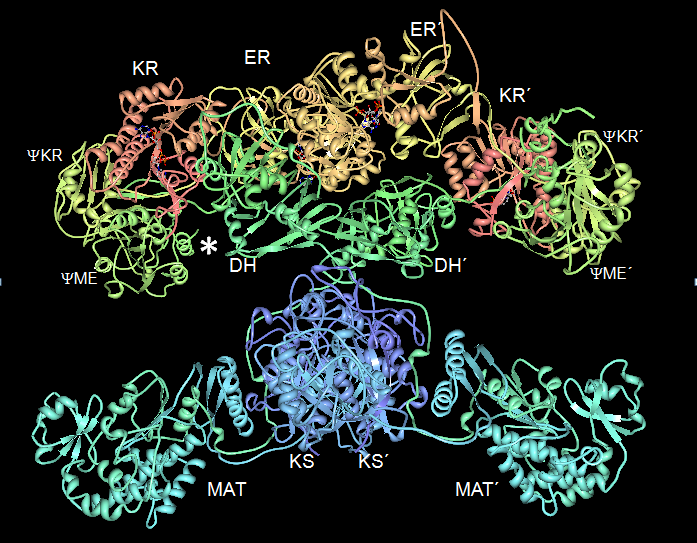 Organización estructural de la AGS de mamíferos
Organización estructural de la AGS de mamíferos
Durante el proceso de síntesis, la cadena de ácido graso o acilo en elongación está unida a la ACP. La ACP posee un resto de fosfopanteteína, grupo prostético unido a un resto de Ser de la proteína, que es un grupo flexible
que mueve el grupo acilo entre los diferentes sitios activos de la megasintasa. Los intermediarios de la síntesis de ácidos grasos se unen al extremo sulfhidrilo de este grupo fosfopanteteína mediante un enlace tioéster.
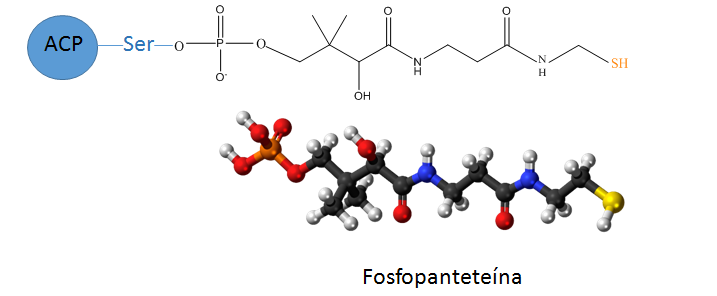
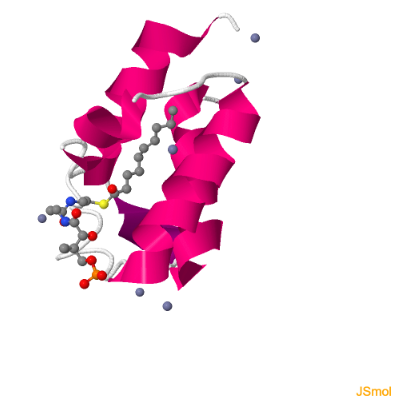
El ácido graso creciente se acomoda unido a la fosfopanteteína mediante un enlace tioéster en la cavidad central de la ACP. En el siguiente modelo se muestra la estructura de la ACP de E.coli cargada con un acilo de 10 átomos
de carbono, decanoil-ACP.
Estructura de decanoil-ACP de E.coli
Biosíntesis de ácidos grasos
Etapa inicial en la síntesis de ácidos grasos
Para comenzar la síntesis de un ácido graso, la sintasa “se carga” con un grupo acetilo, aportado por Acetil-CoA, y un grupo malonilo aportado por Malonil-CoA. Primero se transfiere el grupo acetilo del Acetil-CoA a la ACP, y de ésta al grupo –SH de una
cisteína del dominio KS de la AGS (Acetil-KS). Después, el grupo malonilo se transfiere a la ACP (Malonil-ACP).
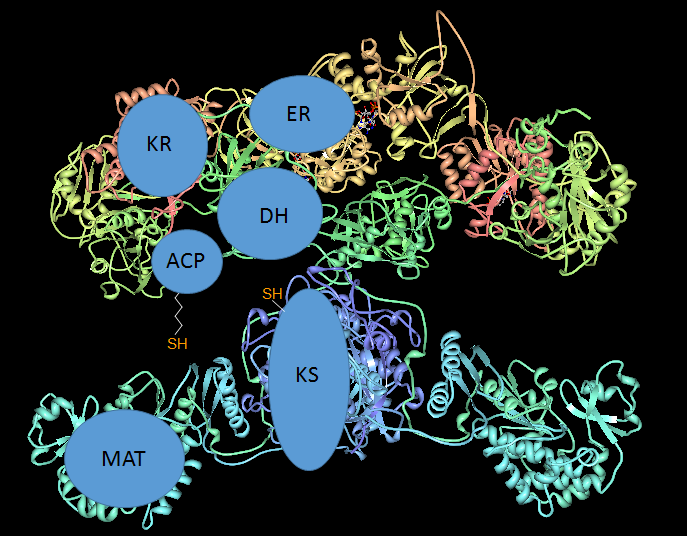 Esquema de los dominios de la AGS
Esquema de los dominios de la AGS
Ambas transferencias están catalizadas por el dominio MAT de la AGS.
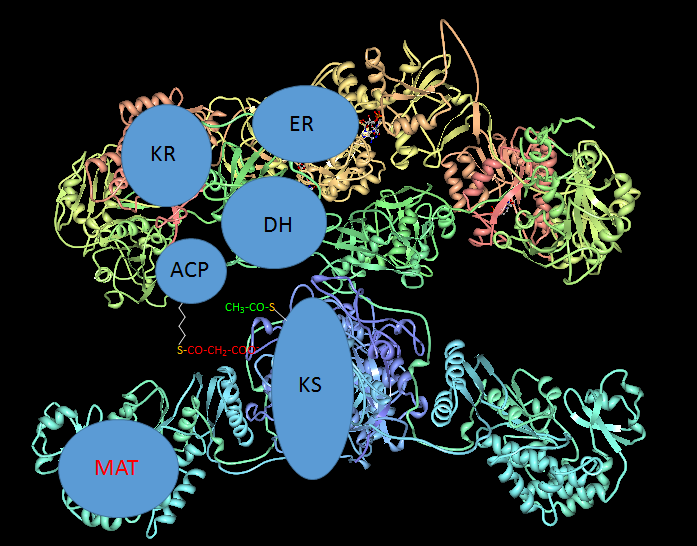 AGS cargada con un grupo acetilo (Acetil-KS) y un grupo malonilo (Malonil-ACP)
AGS cargada con un grupo acetilo (Acetil-KS) y un grupo malonilo (Malonil-ACP)
Elongación
A partir de este momento, el acilo unido a KS (Acetil-KS) se elongará en dos carbonos procedentes del Malonil-ACP mediante cuatro reacciones sucesivas: condensación, reducción, deshidratación y reducción.
1. Condensación de los grupos acetilo y malonilo, catalizada por el dominio KS que transfiere el acetilo desde KS a la ACP. El acilo resultante de 4 átomos de carbono queda unido a la ACP y se libera una molécula de CO2.
Este primer intermediario es un β-ceto-acil-ACP.
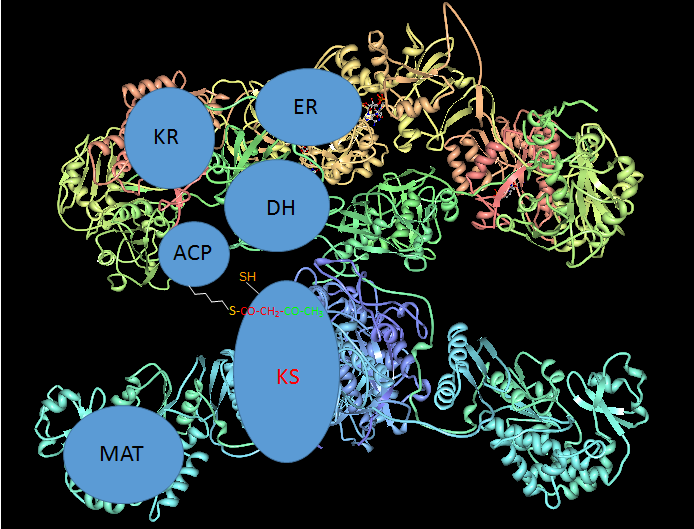 Condensación de los grupos acetilo y malonilo, catalizado por KS
Condensación de los grupos acetilo y malonilo, catalizado por KS
2. Reducción del grupo β-ceto, catalizada por el dominio KR, que utiliza NADPH como cofactor. Se forma un intermediario D-β-hidroxi-acil-ACP.
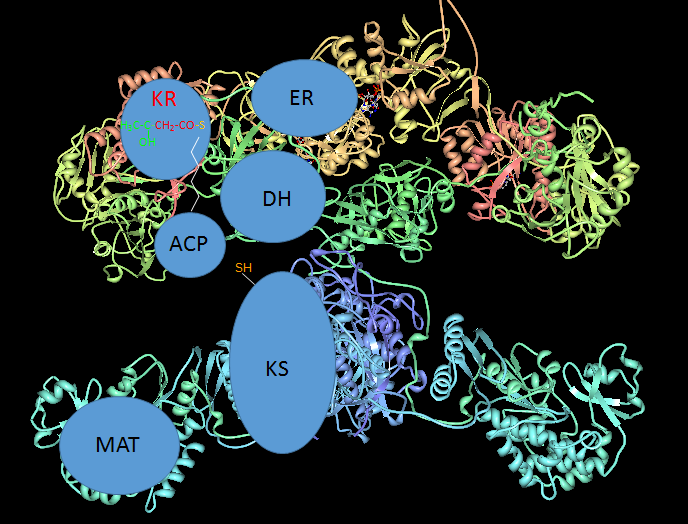 Reducción del grupo ceto, catalizado por KR
Reducción del grupo ceto, catalizado por KR
3. Deshidratación, catalizada por el dominio DH, que da lugar al intermediario trans-Δ2-enoil-ACP.
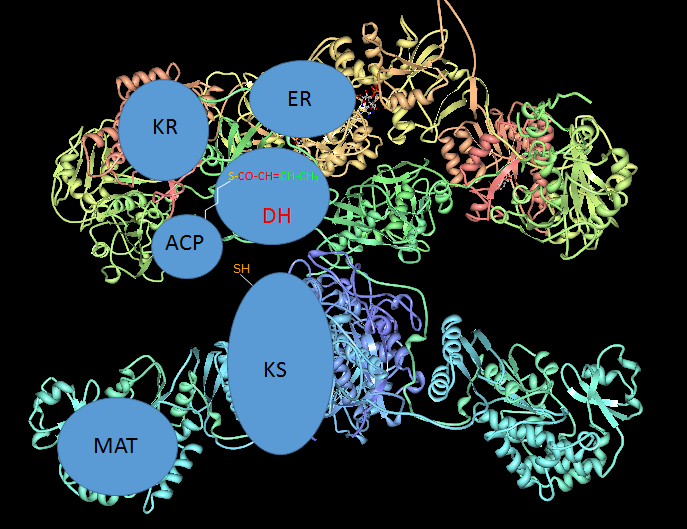 Deshidratación catalizada por DH
Deshidratación catalizada por DH
4. Reducción del doble enlace, catalizada por el dominio ER. El cofactor es de nuevo NADPH. Se forma el Acil-ACP con dos carbonos más.
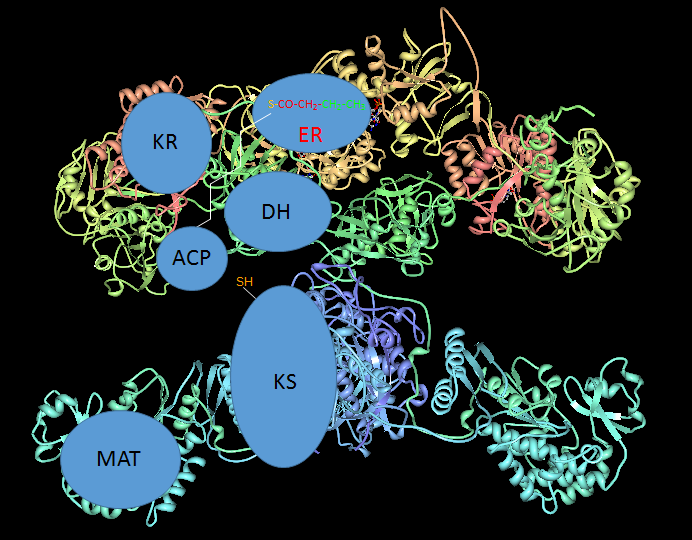 Reducción del doble enlace catalizada por ER
Reducción del doble enlace catalizada por ER
El brazo oscilante de la ACP conecta el acilo con los diferentes centros catalíticos.
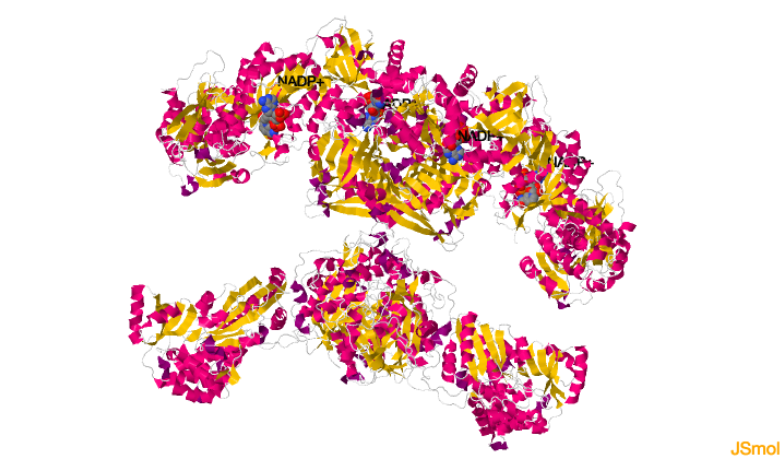
Para las reacciones de reducción 2 y 4, catalizadas por los dominios KR y ER, son necesarias sendas moléculas de NADPH (en el modelo siguiente en esferas CPK) que actúa como donador de electrones.
La AGS unida a NADP+
Translocación y “recarga” de la ACP
5. Una vez reducido, el acilo es transferido desde la ACP hasta el resto de Cys de la KS (catalizado por MAT).
 Transferencia del acilo desde ACP a KS
Transferencia del acilo desde ACP a KS
6. Finalmente, la ACP se recarga con otro grupo Malonilo para volver a repetir los cinco pasos anteriores hasta completar la síntesis del ácido palmítico.
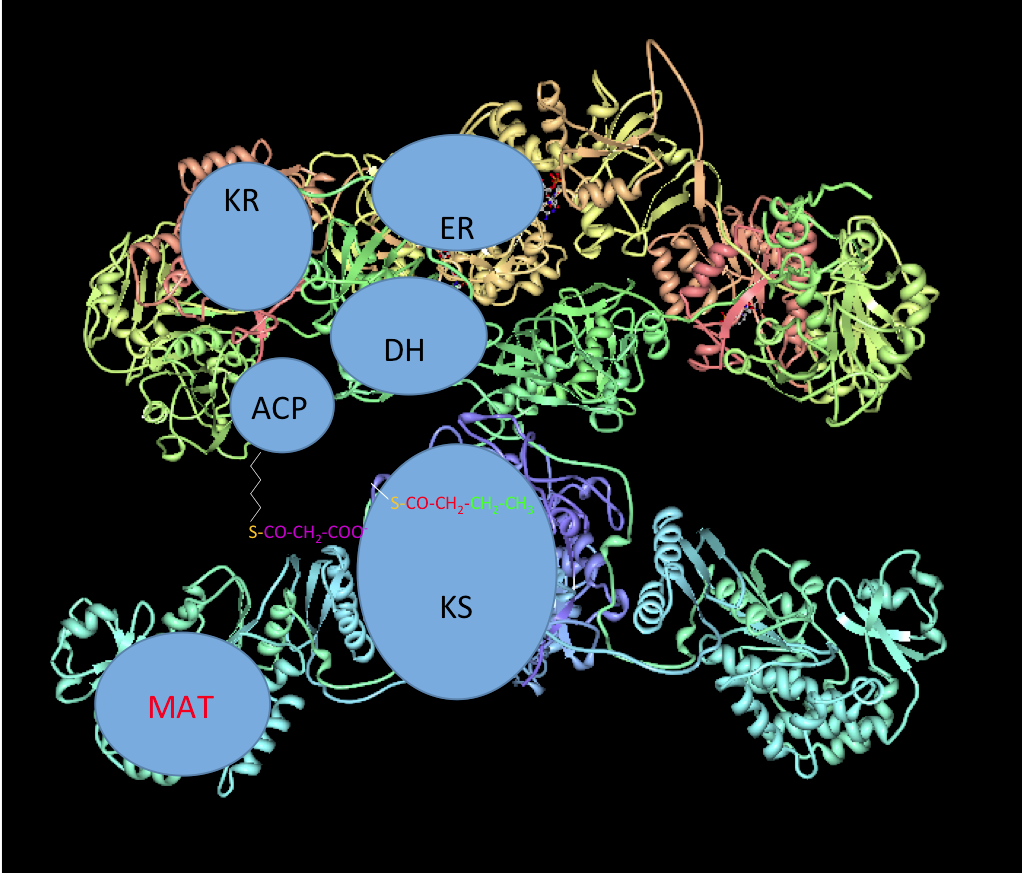 Recarga de ACP con otro grupo malonilo
Recarga de ACP con otro grupo malonilo
Este ciclo de seis reacciones se repite hasta completar la cadena del ácido graso. Cada ciclo puede resumirse según la ecuación:

En la biosíntesis del ácido palmítico, tras el último ciclo, el grupo palmitoilo de la ACP se hidroliza por la actividad TE, liberándose el palmitato.
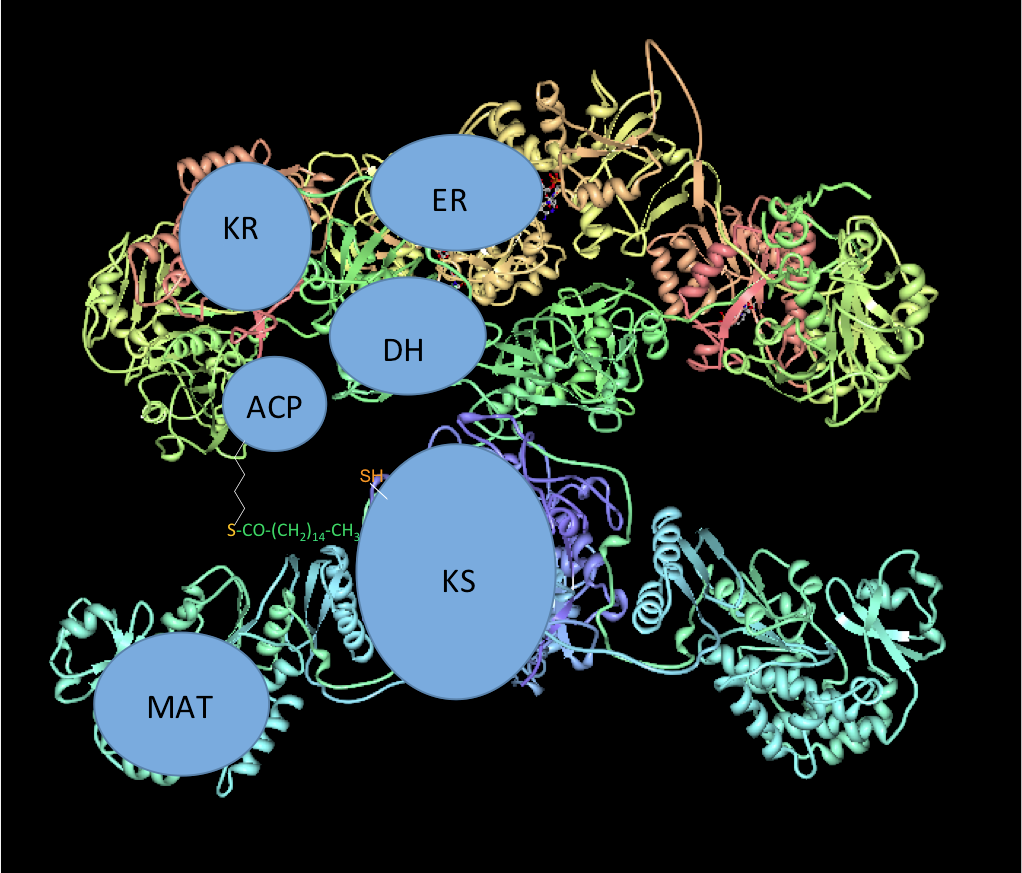 El palmitoil-ACP se libera como palmitoil-CoA por la enzima Acil tioesterasa
El palmitoil-ACP se libera como palmitoil-CoA por la enzima Acil tioesterasa
En algunos tipos de cáncer, las células cancerígenas expresan niveles anormalmente altos de AGS y elevadas tasas de síntesis de ácidos grasos, por lo que inhibidores de esta enzima podrían usarse como agentes anti-cancerígenos.
Cuestiones
Responder al cuestionario correspondiente en la página de Studium
Referencias
Goodsell D. RCSB PDB Molecule of the Month doi: 10.2210/rcsb_pdb/mom_2007_6
Lehninger, A.L.; Nelson, D.L. & Cox, M.M. (2009) Principios de Bioquímica, 5ª ed. Omega,
Barcelona.
Maier, T.; Leibundgu, M. & Ban, N. (2008) The crystal structure of a mammalian fatty acid synthase. Science 321, 1315-1322. DOI: 10.1126/science.1161269
Mathews, C. K.; van Holde, K. E. &Appling D.R. (2013) Bioquímica, 4ª ed. Pearson Educación, Madrid.
PDB www.rcsb.org, H.M. Berman, J. Westbrook, Z. Feng, G.
Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) The Protein Data Bank URL: Nucleic Acids Research, 28: 235-242.