La ATP sintasa (ATPasa o F1/Fo ATPasa o Complejo V) es la enzima encargada de acoplar el transporte de electrones y la síntesis de ATP o fosforilación oxidativa, en la respiración celular.


La ATP sintasa (ATPasa o F1/Fo ATPasa o Complejo V) es la enzima encargada de acoplar el transporte de electrones y la síntesis de ATP o fosforilación oxidativa, en la respiración celular.
Las coenzimas reducidas NADH y FADH2 contienen los electrones procedentes de la mayoría de los procesos oxidativos (glucólisis, oxidación del piruvato, ciclo de Krebs, β-oxidación de los ácidos grasos). Los electrones se transfieren hasta el aceptor final, el O2, a través de la cadena de transportadores de electrones o cadena respiratoria de la membrana mitocondrial. Asociado al transporte de electrones se establece un bombeo de protones a través de la membrana mitocondrial interna desde la matriz mitocondrial (Lado N (-)) al espacio intermembrana (Lado P (+)). El gradiente de protones genera una fuerza protón motriz con dos componentes, el potencial eléctrico Ψ, y el gradiente de protones ΔpH.
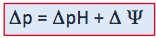
La fuerza protón motriz se emplea para acoplar el transporte de electrones con la fosforilación oxidativa: el exceso de protones pasa a través de la membrana interna de nuevo a la matriz a través de canales de la ATP sintasa, impulsando la síntesis de ATP.
La ATP sintasa presenta estructura en forma de chupete, dispuesta en las células eucariotas en la membrana mitocondrial interna hacia la matriz mitocondrial. Está constituida por dos subunidades, la subunidad Fo, componente que atraviesa la membrana interna mitocondrial, y la subunidad F1, esférica de 85 Å de diámetro, que sobresale hacia la matriz mitocondrial.
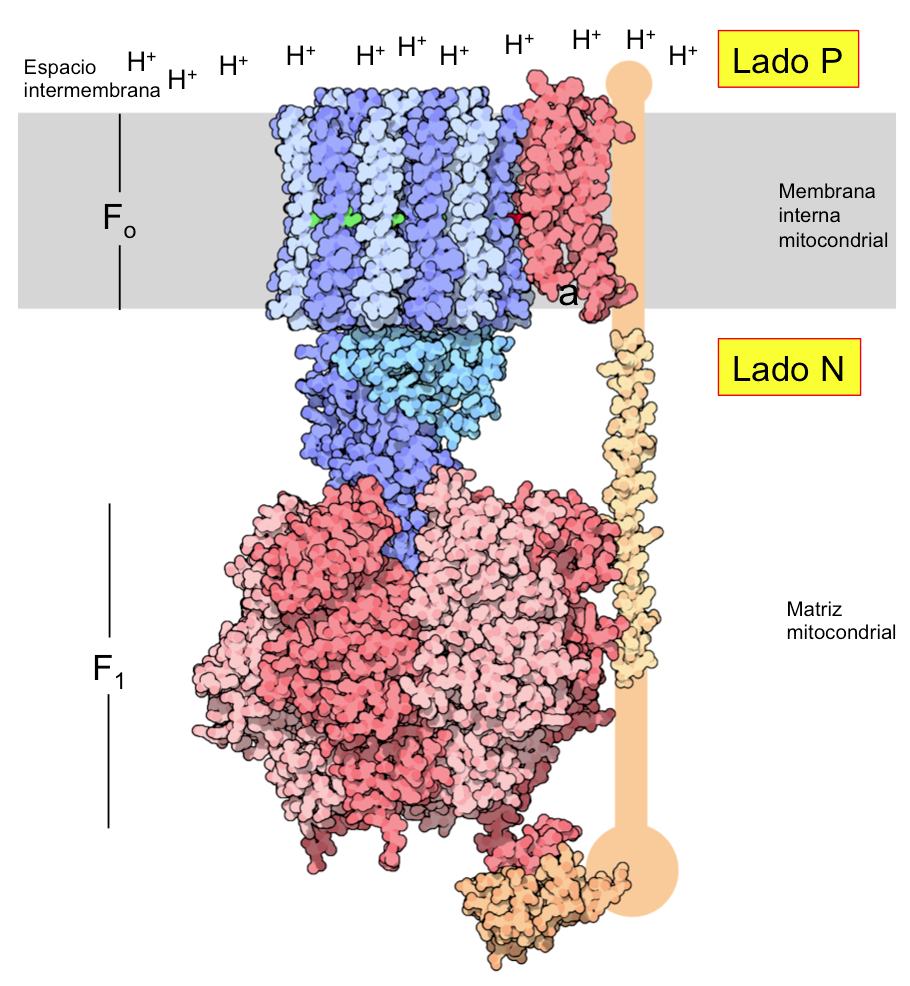
Está constituida por tres tipos de subunidades :
a (1 subunidad). b (2 subunidades) c (de 8 a 15 subunidades dependiendo de la especie)
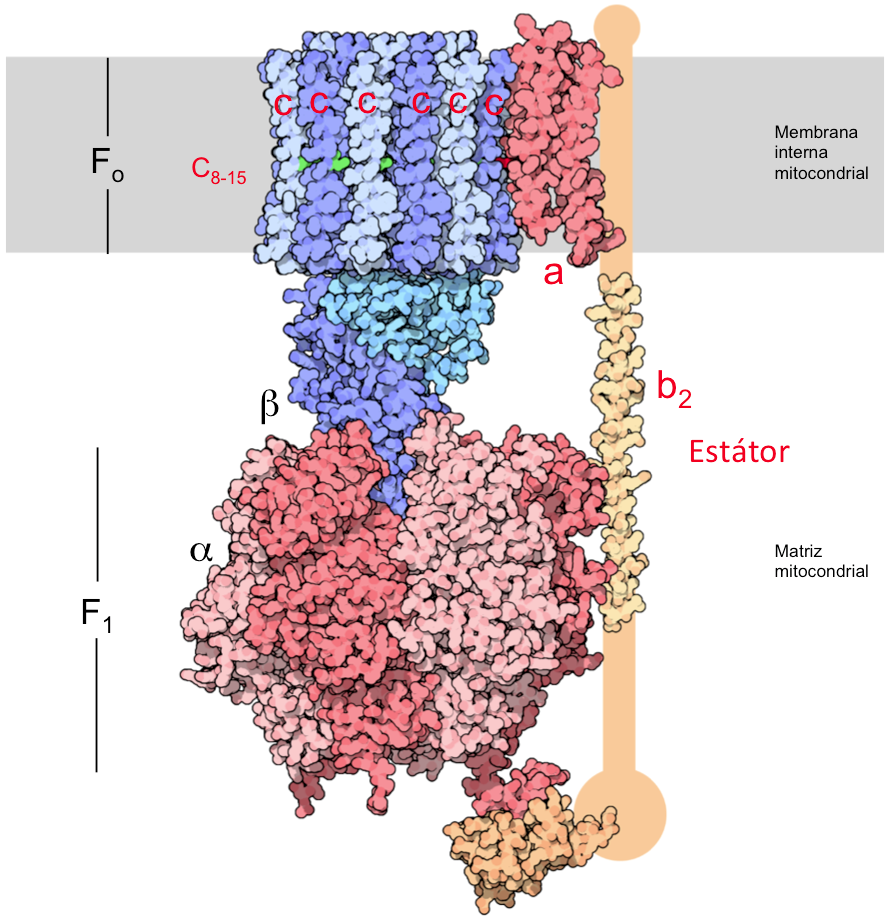
La subunidad a (en verde en el modelo mostrado más abajo) se apoya directamente en el anillo c. Forma dos semiconductos o semicanales hidrofílicos que no atraviesan por completo la membrana. Por estos canales pasarán los H+ desde el lado P al lado N sin atravesar la membrana. La subunidad c (en rosa oscuro en el modelo) forma un anillo hidrofóbico que atraviesa la membrana interna mitocondrial.
Cada subunidad c posee un resto de Asp, el Asp61 en la ATP sintasa bacteriana, en el centro de una de las dos hélices α que atraviesan la membrana.
El Asp61 de la subunidad c interacciona con la Arg210 de la subunidad a. En el siguiente modelo puede observarse el anillo formado por 12 subunidades c coloreadas en rosa oscuro con los residuos de Asp61 marcados, y la subunidad a en verde con el residuo de Arg210 en estilo “esqueleto wireframe” de la ATP sintasa Escherichia coli.
Por su parte, la subunidad b (ver Imagen 2) conecta Fo con F1 sirviendo de elemento estático (estátor) durante la catálisis rotacional (ver más abajo).
Está formada por cinco polipéptidos diferentes:
α (3 subunidades). β (3 subunidades). Contiene el centro activo. γ (1 subunidad). Eje central rotatorio de la subunidad F1. δ (1 subunidad). ε (1 subunidad).
El grueso de F1 está constituido por tres pares αβ. La subunidad γ constituye un largo eje helicoidal que ocupa en centro del hexámero α3β3 (en color gris claro en el modelo). El anillo c y el tallo γε constituyen la
parte móvil del complejo (rotor) frente al resto de la molécula que forma la parte estática (estátor).
Las subunidades β contienen el centro activo e interaccionan asimétricamente con la subunidad γ . En el siguiente
modelo, las subunidades β se muestran en estilo “wireframe” y puede observarse la localización la molécula de
ATP (en azul oscuro) en el centro activo.
Catálisis rotacional y Mecanismo de cambio de unión (P. Boyer)
En la subunidad catalítica de la ATP sintasa se sintetiza ATP de acuerdo con la reacción:
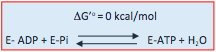
La concentración de H20 en el centro activo es muy pequeña, y la enzima se une más fuertemente al ATP que al ADP. Todo ello hace que el equilibrio de la reacción se desplace hacia la formación de ATP.
Por tanto,
la síntesis de ATP en el centro activo de la subunidad β catalítica no precisa de un aporte energético. La energía es necesaria para que se libere el ATP mediante el mecanismo “cambio de unión” y catálisis rotacional.
Cambio de unión.Las subunidades β de F1 pueden presentar tres conformaciones diferentes que poseen distintas afinidades por los nucleótidos:
Abierta O: Nula afinidad. Los nucleótidos pueden unirse o liberarse. Laxa L: Poca afinidad. Los nucleótidos quedan retenidos (Unión y retención de ADP y Pi). Tensa T: Alta afinidad. Se sintetiza el ATP.
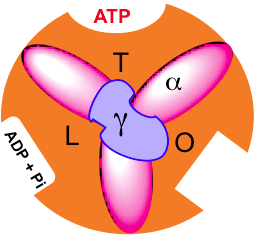
La interacción de cada subunidad β con la subunidad γ hace que las tres subunidades β NO sean equivalentes. La rotación de la subunidad γ, que gira 120º en el sentido contrario a las agujas del reloj (mirando desde la matriz), interconvierte la subunidad β entre las tres formas.
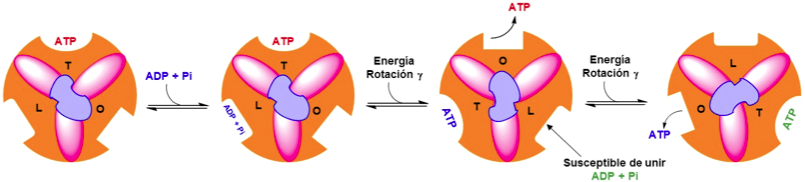
Catálisis rotacional. El movimiento de protones a través de la subunidad Fo de la ATP sintasa determina la rotación de la subunidad γ. Un protón entra en el semiconducto de la subunidad a que mira al espacio intermembrana (Lado P, rico en H+) y pasa desde la Arg210 de la subunidad a, al Asp61 de una de las subunidades del anillo c neutralizando su carga. Cuando la subunidad c une un protón sufre un cambio conformacional que determina su alejamiento de la subunidad a. El protón inicial, después de dar una vuelta completa al anillo c, se libera a la matriz (Lado N) por el semiconducto de la subunidad a que mira a la matriz. En definitiva, la fuerza protón motriz determina la rotación del anillo c, que a su vez provoca el movimiento de la subunidad γ, que a su vez modifica la conformación de las subunidades β. Se necesita bombear 3 H+ para que la subunidad γ gire 120º y se libere una molécula de ATP. En este video se resume el mecanismo de síntesis de la ATP sintasa.
En resumen, los protones bombeados al espacio intermembrana (Lado P) durante el transporte electrónico pasan a la matriz mitocondrial (Lado N) a través del canal de Fo, acoplándose con la liberación del ATP sintetizado en la subunidad F1. Por tanto, la función de la fuerza motora de protones NO es la síntesis de ATP sino su liberación de la sintasa.
Responder al cuestionario correspondiente en la página de Studium
ATP synthase: Structure and Function. Stewart Group. https://www.youtube.com/watch?v=b_cp8MsnZFA
Boyer, P. D. (1997) The ATP Synthase-A Splendid Molecular
Machine. Annual Review of Biochemistry 66, 717-749.
Goodsell D., RCSB PDB Molecule of the Month doi:10.2210/rcsb_pdb/mom_2005_12
PDB www.rcsb.org, H.M. Berman, J. Westbrook,
Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) The Protein Data Bank URL: Nucleic Acids Research, 28: 235-242.
Stryer, L. BIOQUÍMICA. Curso Básico. Reverté. (2014). 2ª ed.