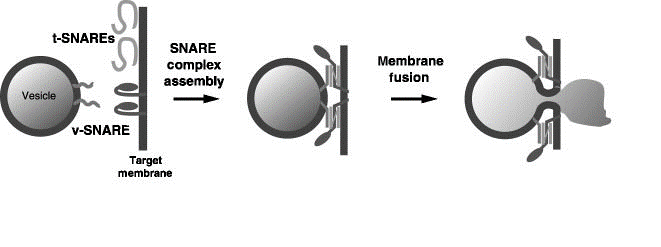
Acoplamiento y fusión de membranas.
Como se ha explicado antes, tanto sinaptobrevina como sintaxina y SNAP-25, poseen dominios específicos que interaccionan entre sí a modo de cremallera que se cierra desde los extremos N-terminales en dirección a los C-terminales.
De esta forma, se genera el complejo de cuatro hélices extremadamente estable que permite la aproximación de la membrana vesicular a la membrana plasmática y que precede a la fusión de membranas. Sin embargo, la liberación de
neurotransmisores no requiere únicamente de la presencia de las v o t-SNARE, sino también de otros factores determinantes como Munc18 y Munc13 (Figura 2).
Munc18 interacciona con sintaxina; esta última tiene dos conformaciones, una auto-inhibida (cerrada) y otra abierta. La conformación cerrada impide la interacción con los dominios SNARE de sinaptobrevina y SNAP-25 y se mantiene
gracias a Munc18 actuando a modo de capuchón y evitando el paso al estado abierto (Figura 2B.1).
La correspondiente transición del estado cerrado al abierto de la sintaxina y en última instancia, la formación del complejo SNARE (four helical bundle), requiere de Munc13 (Figura 2B.2). Al igual que Munc18, esta
proteína de 20kDa también es necesaria para la liberación del neurotransmisor. Entre sus dominios a destacar, encontramos MUN, encargado de catalizar tal transición.
Es posible que ambas proteínas no solo eviten que el complejo SNARE sea disociado por la acción conjunta de NSF-SNAP, como se explicará más adelante, sino que debido a su tamaño, evita que se produzca el acercamiento de las dos
membranas a la vez que el complejo SNARE realiza la acción contraria, actuando como un mecanismo regulador de este proceso. Además, la combinación de las fuerzas opuestas ejercidas podría tener un papel esencial en la fusión de membranas
al iniciar su curvatura y posterior desestabilización (Figura 2B.2 y 3).
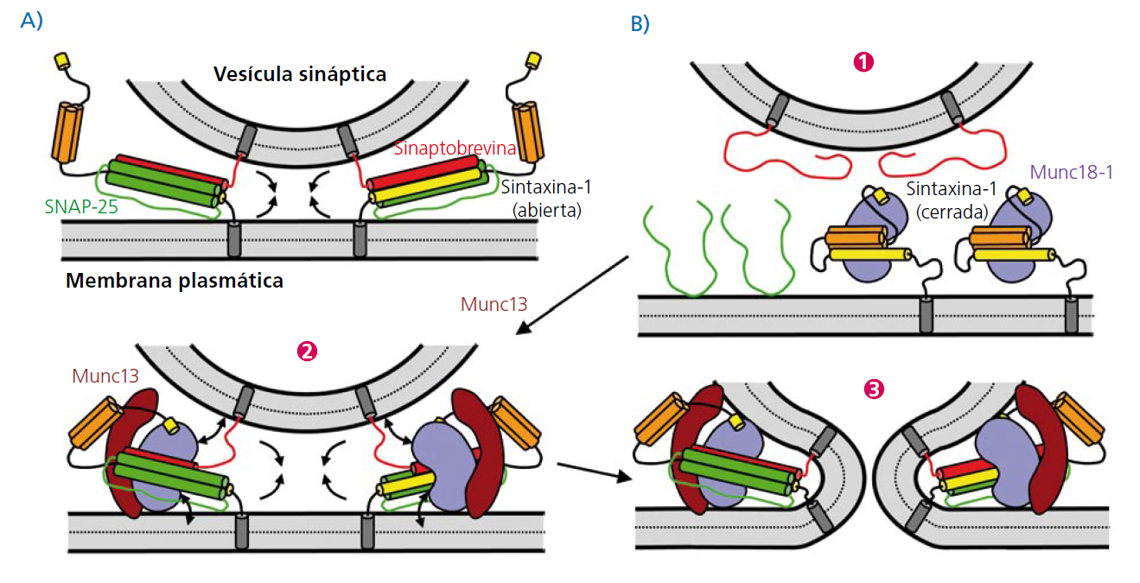 Figura 2. Modelos de fusión de membranas mediada por proteínas SNARE, Munc18 y Munc13 (tomada de Fernández-Chacón & Rizo, 2015).
Figura 2. Modelos de fusión de membranas mediada por proteínas SNARE, Munc18 y Munc13 (tomada de Fernández-Chacón & Rizo, 2015).
Por otro lado, cabe destacar que los dominios SNARE de la
sinaptobrevina y
sintaxina están conectados a dominios transmembrana (
TMDs) por el C-terminal vía una región ‘linker’ corta, que hace que ambas estén embebidas en sus respectivas membranas por este anclaje con
TMDs (Figura 3).
SNAP-25 por el contrario, consiste en dos dominios SNARE, conectados por otro ‘linker’ y unidos a la membrana por múltiples colas de palmitoil. Las regiones ‘linker’ sirven como maquinaria de transmisión de la
fuerza, es decir, envían el estrés generado por la formación del complejo SNARE hacia las membranas, desencadenando la fusión. Es por ello que su eficacia viene determinada no solo por la flexibilidad, sino también por su rigidez,
ya que una gran rigidez implica una dificultosa reorientación del complejo SNARE e impide el acercamiento de membranas.
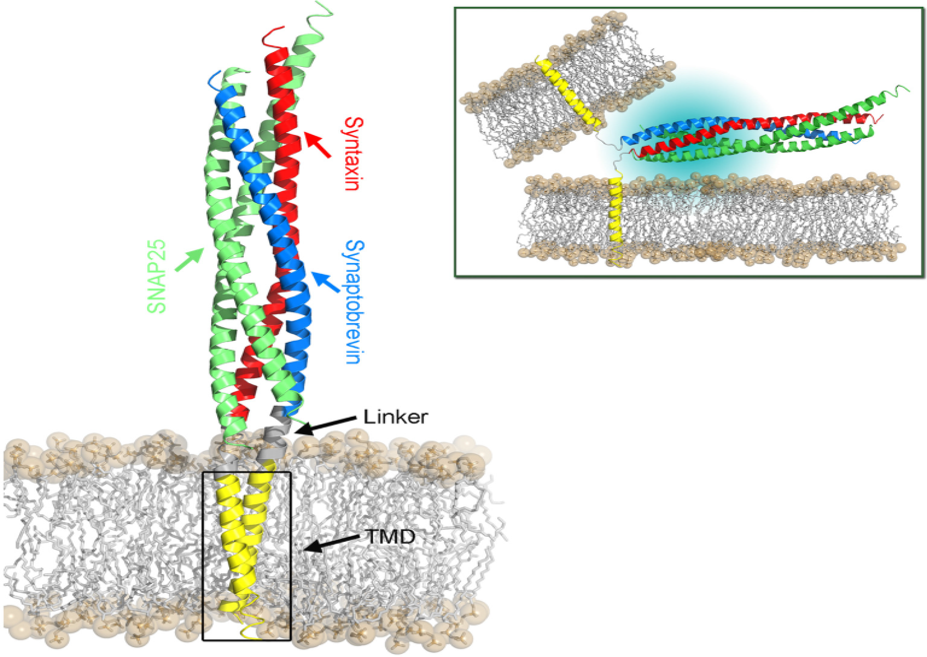 Figura 3. Modelos estructural del complejo SNARE embebido en una membrana lipídica (tomada de Hanetal, 2017.
Figura 3. Modelos estructural del complejo SNARE embebido en una membrana lipídica (tomada de Hanetal, 2017.
El mecanismo de fusión de membranas desencadenado por las proteínas SNARE tiene similitudes con el llevado a cabo por las proteínas de fusión víricas.
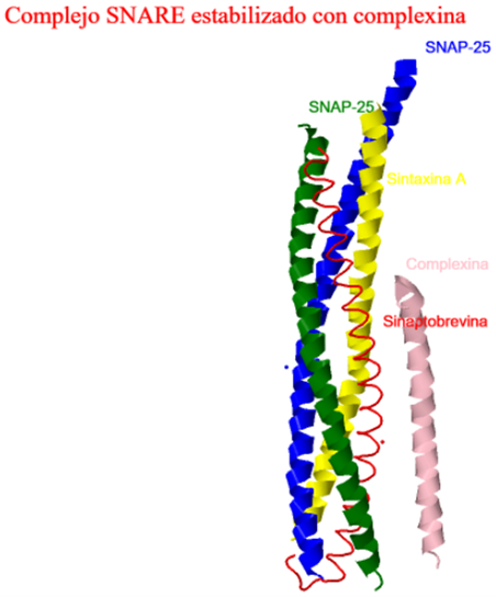
La unión de complexina estabiliza el complejo SNARE.
Debemos destacar la importancia de proteínas adicionales que participan en el ensamblaje y desensamblaje del complejo, tal es el caso de la complexina vista más arriba, que se une fuertemente al complejo y es esencial para la
liberación eficiente de neurotransmisores provocada por la afluencia de Ca+2.
Un análisis de resonancia magnética nuclear (RMN) reveló que la complexina carece de una estructura terciaria, pero contiene una región en alfa-hélice, antiparalela a las otras cuatro hélices alfa del complejo SNARE (ver más arriba), situada en el medio de su secuencia, y que es la responsable de la unión al complejo; el extremo C-terminal de la hélice de complexina se une al centro del surco que se forma entre la sinaptobrevina y sintaxina, mientras que
el extremo N-terminal de la hélice no contacta directamente con el complejo SNARE. Esta unión causa cambios estructurales mínimos e involucra una compleja red de interacciones hidrofóbicas, puentes de hidrógeno e interacciones
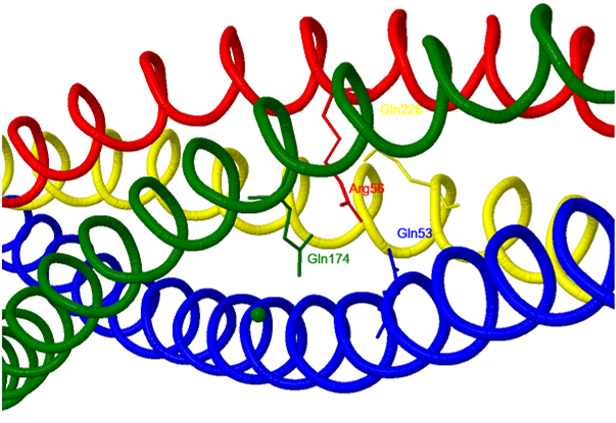
iónicas entre los residuos 48-70 de la complexina y las secuencias que abarcan los residuos 47-68 de la sinaptobrevina, y los residuos 214–232 de sintaxina. Dos tirosinas (Y52 e Y70), tres residuos de arginina
(R48, R59 y R63) y un residuo de lisina (K69) de la complexina parecen ser críticos para la unión al complejo SNARE. En el siguiente modelo se destaca la interacción de los residuos
Y70 y
K69 (en azul) de la complexina con
D214 y
D218 de la sintaxina (en verde).
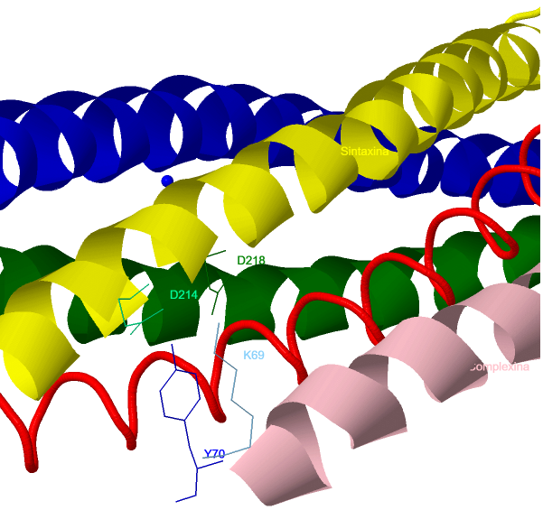
Residuos de complexina que interaccionan con el complejo SNARE.
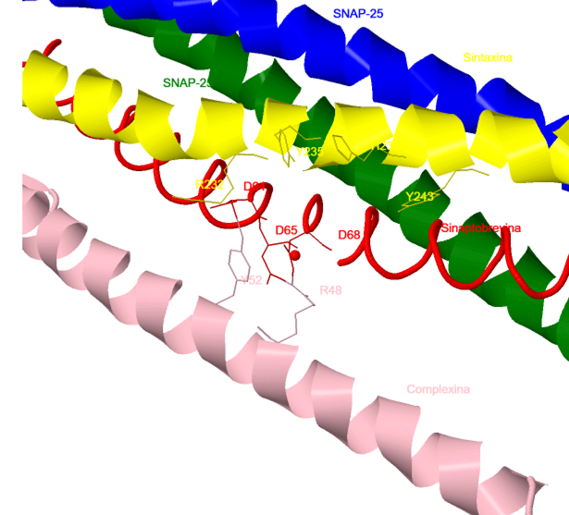
Además, en el siguiente modelo, se ilustra la proximidad a la interfaz complexina/complejo SNARE de tres residuos aromáticos próximos de la sintaxina (Y235,
H239, y
Y243).
Residuos importantes en la interfaz complexina-complejo SNARE.
Separación del complejo SNARE.
Una vez que las proteínas SNARE han hecho su trabajo, deben desmontarse y reciclarse para poder volver a actuar. NSF (N-ethylmaleimide-sensitive factor), enzima de la familia de ATPasas AAA +, (ATPases Associated with diverse cellular Activities),
realiza esta importante tarea; hidroliza ATP y usa la energía disponible para modificar el sitio de acoplamiento y disociar el coiled-coil formado por v y t-SNARE. Está compuesto por un anillo de seis subunidades, cada una
con su propio sitio para la unión e hidrólisis de ATP, en cuyo agujero central se produce el desensamblaje de los complejos SNARE. En el siguiente modelo se observa la oligomerización del dominio de unión a ATP de seis monómeros
de NSF.
Hexamerización del dominio de unión a ATP de NSF.
Aspectos de interés:
Toxina botulínica:
La toxina botulínica es una toxina producida por Clostridium botulinum. Es la toxina más potente conocida. La inhibición de la liberación de los neurotransmisores por estas toxinas es causada por la separación del complejo
SNARE. Solo es necesario que una de las proteínas que formen el complejo SNARE se separe para que se bloquee la salida de los contenidos vesiculares al ambiente extracelular. La toxina botulínica realiza una degradación proteolítica de la sinaptobrevina la
cual se encarga de liberar acetilcolina al unirse a SNAP-25 y a la sintaxina como hemos visto más arriba. Esto provoca que no se produzca la contracción muscular y por tanto, una parálisis flácida que acaba con la muerte del individuo
por parada cardio-respiratoria. En cantidades mínimas da lugar a un músculo inhábil de contraerse por lo que se puede utilizar en campos como medicina (estrabismo, hiperhidrosis severa, distonía cervical, etc.) o cosmética (botox).
En el siguiente esquema se resume el mecanismo de acción de la toxina botulínica: la toxina botulínica se une a la membrana (1), se integra en el elemento presináptico (2) y se libera al citoplasma (3). Allí degrada proteolíticamente
alguna de las proteínas del complejo SNARE (4) impidiendo que éste se forme y por tanto la liberación de la acetilcolina de la vesícula al espacio sináptico.
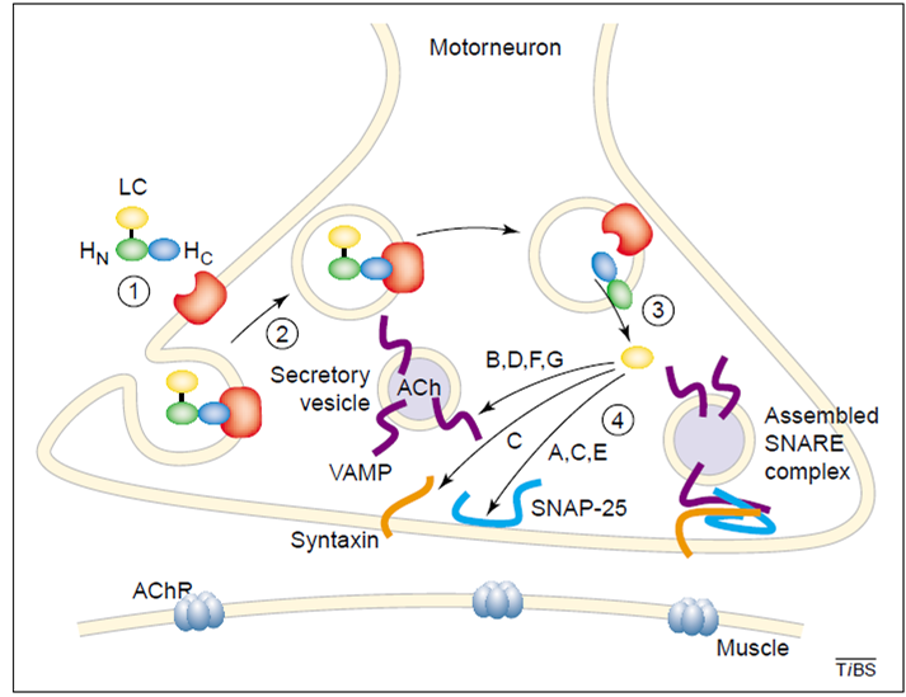 Figura 4. Mecanismo de acción de la toxina botulínica. A, B, C, D, E, F: distintos tipos de toxina botulínica; LC, HN, HC: dominios de la toxina botulínica (LC, cadena ligera con actividad endopeptidasa); ACh: acetilcolina; AchR: receptor de acetilcolina
(tomada de Turton, et al. 2002).
Figura 4. Mecanismo de acción de la toxina botulínica. A, B, C, D, E, F: distintos tipos de toxina botulínica; LC, HN, HC: dominios de la toxina botulínica (LC, cadena ligera con actividad endopeptidasa); ACh: acetilcolina; AchR: receptor de acetilcolina
(tomada de Turton, et al. 2002).
Un efecto parecido tiene la toxina tetánica que impide la liberación de inhibidores de acetilcolina produciendo una contracción simultánea de músculos antagonistas y finalmente la muerte por asfixia.
Esquizofrenia:
La esquizofrenia es una enfermedad cuya causa es poco conocida. Diversos grupos de investigación han observado un aumento en la expresión de proteínas SNARE como una isoforma de la sintaxina o de algunas isoformas de la
proteína
Munc18 en individuos con esquizofrenia en estudios postmortem. También se produce un aumento de la cantidad de los complejos SNARE en la corteza prefrontal de individuos con esquizofrenia. Sin embargo, también se produce
la disminución de alguna de las formas de los complejos por lo que un desbalance en la interacción entre las proteínas SNARE (especialmente sintaxina-1A) y munc18-a podría ser la base de esta enfermedad.
Marcador de enfermedades neurodegenerativas:
Una de las nuevas aproximaciones en las que se está trabajando es en la utilización de estos complejos SNARE como marcador en enfermedades neurodegenerativas como Alzheimer (sobreexpresión de sintaxina). Por otro
lado, se ha visto que diversos polimorfismos en SNAP-25 se pueden asociar a hiperactividad o déficit de atención. Finalmente, en individuos fallecidos por la enfermedad de Huntington se detectó una disminución de
los complejos SNARE.
Papel en el transporte de glucosa (diabetes):
En los adipocitos, la capacidad de translocar glucosa por parte del transportador GLUT4 viene dada por una serie de complejos SNARE. Diversos experimentos han sugerido que una alta concentración de glucosa en los adipocitos tiene un efecto tóxico en la
secreción de insulina por una disminución de la expresión de las proteínas SNARE que participan en ella. Esto puede provocar en el individuo diabetes ya que no se libera correctamente la insulina
y por tanto los niveles de glucosa en sangre no serán los adecuados.
Guion elaborado por Diego Pérez Fernández, Sergio San Miguel Escudero, José Antonio Sánchez Castro y Alejandro Sánchez Sánchez, alumnos de Química e Ingeniería de Proteínas, 3er curso del Grado en Biotecnología, curso 2019/20.
Cuestiones
Responder al cuestionario correspondiente en la página de Studium
Referencias
Chen, X., Tomchick, D.R., Kovrigin, E., Arac D, Machius, M., Sudhof, T.C. & Rizo, J. (2002) Three-dimensional structure of the complexin/SNARE complex. Neuron 33, 397-409.
Fernández-Chacón, R. & Rizo, J. (2015). Sinapsis: maquinarias moleculares para la comunicación neuronal. Revista SEBBM 183, 12-16
Goodsell, D. (2013). SNARE Proteins. Molecule of the Month doi: Molecule of the Month doi:
0.2210/rcsb_pdb/mom_2002_10
Han, J., Pluhackova, K. & Bökmann, R.A. (2017). The Multifaceted Role of SNARE Protein sin Membrane Fusion. Front. Physiol. 8:5, 1-17.
PDB
www.rcsb.org, H.M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne (2000) The Protein Data Bank URL: Nucleic Acids Research, 28: 235-242.
Rothman, J. E. & Wieland, F. T. (1996). Protein sorting by transport vesicles. Science 272, 227–234.
Torrejón Escribano, B. (2012). Cambios en la expresión y distribución de las proteínas SNARE en la célula beta pancreática y en un modelo de tejido adiposo. Tesis doctoral, Universidad de Barcelona. Dialnet, Universidad
de la Rioja, 2001-2019. https://dialnet.unirioja.es/servlet/tesis?codigo=119122
Turton, K., Chaddock, J. & Acharya, K. (2002). Botulinum and tetanus neurotoxins: Structure, function and therapeutic utility. Trends Biochem Sci 27, 552–8.
Ungar, D. & Hughson, F.M. (2003). SNARE protein structure and function. Annu. Rev. Cell Dev. Biol. 19, 493–517.